Medicina di genere [MEDICINA DI GENERE] Farmacologia di genere |  |
Introduzione
Differenze di genere nella salute e nell’assistenza sanitaria sono state descritte in tutto il mondo. Le donne, ad esempio, hanno una più alta aspettativa di vita se comparate all’uomo. Un’aspettativa più lunga di vita non implica una migliore qualità della stessa; infatti, le donne affrontano un maggior carico di malattie, e ciò costituisce uno dei motivi che spingono a promuovere la medicina di genere.
Perché genere? È noto che la risposta terapeutica dipende dalle interazioni tra geni, ambiente e cultura (Fig. 1), perciò è importante soffermarci per definire i concetti di sesso e genere.
Il sesso comprende tutto ciò che riguarda la biologia (geni, ormoni ecc.), mentre il concetto di genere, approdato alle scienze biomediche dopo essere stato, per molti anni, un patrimonio delle scienze umane, include le influenze culturali e sociali. Per alcuni anni i concetti di sesso e genere sono stati contrapposti, ma tale distinzione nella prassi è difficile, poiché il concetto di sesso è molto più complesso di quanto si sia pensato in precedenza. Devono infatti essere considerate numerose, costanti e significative interazioni tra sesso(vita biologica) ed esperienze socio-culturali. In altre parole, potremmo dire che i “fatti” biologici possono essere socialmente costruiti; fatti, poi, che sono selezionati e definiti, nella loro importanza, dal genere 1.
Gli studi di genere, nati in Nord America tra gli anni ’70 e ’80 del secolo scorso, evidenziano che nel campo della salute le differenze di genere stanno sempre più emergendo e riguardano tutti i campi della medicina 2, inclusa la terapia farmacologica 3, anche se specifici studi genere-mirati non sono molto frequenti (vedi lo scarso arruolamento delle donne fino agli ultimi anni e la quasi totale assenza di specifiche analisi per genere). In questo contesto è bene sottolineare che gli studi di genere non costituiscono un nuovo campo di sapere ma rappresentano, soprattutto, una modalità di interpretazione; perciò l’attitudine genere-mirata è applicabile a qualunque branca delle scienze.
La prima descrizione di una differenza di genere in campo farmacologico risale al 1932, quando Nicholas e Barrow evidenziarono che la dose ipnoinducente di barbiturici, nelle ratte femmine, era inferiore del 50% rispetto a quella dei maschi. Questa importante osservazione non ha suscitato l’attenzione che meritava, e per molti anni si è assistito alla rimozione della variabile sesso/genere in campo preclinico e clinico. Ciò ha prodotto una terapia farmacologica basata principalmente sul corpo maschile. E questo è paradossale, in quanto i farmaci risultano meno studiati nel genere che più li usa: le donne. Inoltre, le reazioni avverse sono più frequenti e più gravi nel sesso femminile 3. Le differenze di genere in farmacologia riguardano sia la farmacocinetica sia la farmacodinamica. Fino a poco tempo fa, le prime venivano considerate le più rilevanti, ma oggi quelle farmacodinamiche iniziano a emergere ed è quindi possibile che in un prossimo futuro assumano la stessa importanza rispetto a quelle farmacocinetiche.
In questo articolo la nostra attenzione sarà focalizzata sulle differenze farmacocinetiche e sulle reazione avverse (ADRs).
Studi clinici e genere
Il reclutamento delle donne negli studi di fase 3 è stato scarso fino ai primi anni del terzo millennio per una serie di motivazioni tra cui l’assunto implicito che il corpo della donna fosse essenzialmente lo stesso dell’uomo, solo più piccolo, la difesa del feto da un eventuale rischio tossico, la preoccupazione per la maggiore variabilità dovuta alla ciclicità di vita riproduttiva della donna. Tuttavia, si è assistito a un maggior arruolamento delle donne in fase 3 quando le autorità regolatorie hanno imposto negli Stati Uniti l’inclusione delle donne negli studi in maniera proporzionale all’incidenza della malattia e in modo tale da garantire il potere statistico per evidenziare le differenze. L’inserimento delle donne negli studi clinici pone la necessità di implementare l’analisi dei dati in maniera genere-mirata, ad esempio includendo le fasi mestruali, l’uso di contraccettivi, la menopausa ecc. I critici dell’analisi di genere dicono che per fare ciò gli sponsor vanno incontro a costi proibitivi, ma perché non ci chiediamo quali siano i costi economici e sociali del ritiro dal commercio di farmaci che portano a effetti collaterali nella donna? Per fornire un’informazione completa dobbiamo evidenziare che si è anche osservato un “disagio” femminile a partecipare agli studi clinici, imputabile al ruolo femminile (carenza di tempo legata al ruolo di caregiver, povertà ecc.) 4. Le donne rimangono ancora sottorappresentate nelle fasi 1 e 2; eppure l’analisi della farmacocinetica che si effettua durante queste fasi potrebbe essere vantaggiosa per individuare le potenziali differenze di dosaggio atte a prevenire gli effetti collaterali.
Le differenze farmacocinetiche
Le differenze di genere coinvolgono i diversi parametri della farmacocinetica (Tab. I) ma, cosa ancora più importante, esse possono variare in funzione della fase del ciclo mestruale, della gravidanza (Tab. II), dell’allattamento ed essere anche funzione dell’età.
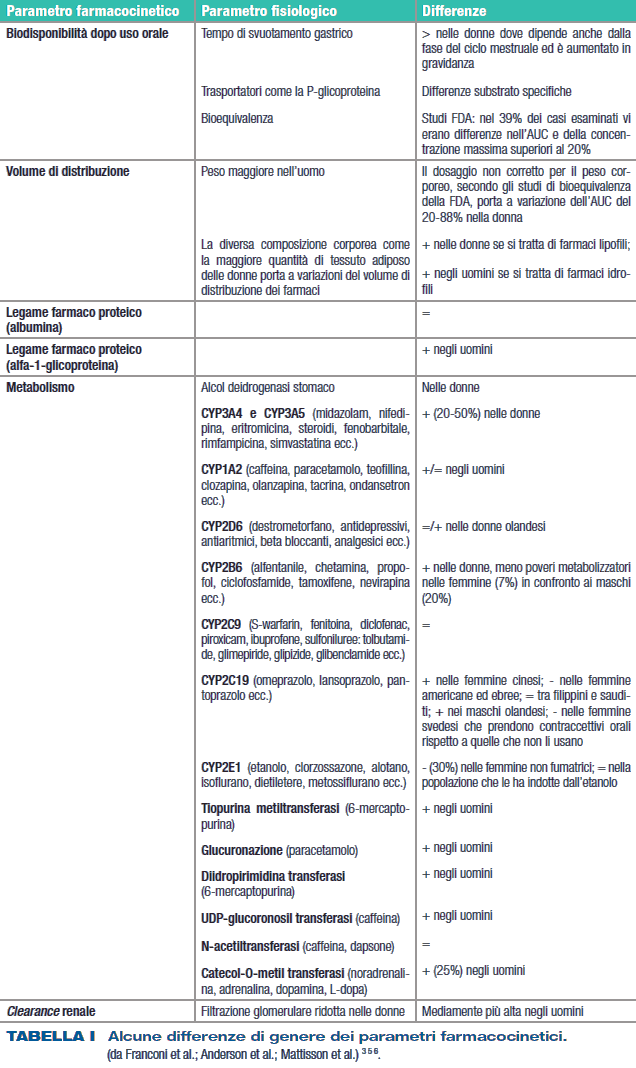

In parte esse dipendono dalle differenze di dimensione e composizione corporea, dal metabolismo e dall’escrezione (Tab. II). Studi di bioequivalenza, valutati dalla Food and Drug Administration (FDA), evidenziano che il non aggiustamento del dosaggio per il peso porta a un aumento dell’area sottesa dalla curva (AUC) nelle donne, che varia dal 20 all’88% rispetto all’uomo 5. È evidente che ciò può avere notevoli conseguenze per i farmaci con basso indice terapeutico. Considerando che il corpo femminile pesa mediamente meno e che ha una quantità di tessuto adiposo superiore (25%) rispetto a quello maschile, non meraviglia che le differenze farmacocinetiche possano essere molto frequenti. Il grasso varia in funzione dell’età, passando dal 33% nelle donne in età fertile al 48% nelle donne anziane, mentre nell’uomo sale dal 18 al 36% nello stesso arco di età. Queste differenze fanno sì che nelle donne i farmaci lipofili tenderanno ad accumularsi nel tessuto adiposo per poi essere rilasciati successivamente, come nel caso degli antipsicotici 7. Appare interessante sottolineare che le differenze legate alle diversità del peso corporeo e della composizione potrebbero ridursi normalizzando la dose per il peso corporeo o per la superficie corporea. Il metabolismo dei farmaci è sessualmente dimorfico (Tab. I) per quanto riguarda gli enzimi di fase 1 e 2. Ad esempio, l’attività della CYP3A4, che metabolizza circa il 50% dei farmaci, è maggiore nel sesso femminile e sembra essere modulata dagli estrogeni e dai progestinici 3. Molte donne, durante l’arco della loro vita, sono trattate con associazioni estroprogestiniche, per cui diventa indispensabile conoscere le interazioni tra queste associazioni e gli altri medicinali (Tab. III).

Questo perché gli ormoni possono influenzare il metabolismo di altri farmaci o, viceversa, il metabolismo degli ormoni può essere influenzato dalla contemporanea assunzione di altri medicinali. La presenza di induttori e di inibitori degli enzimi e di polimorfismi genetici impedisce di arrivare a conclusioni generali, per cui diventa necessario studiare ogni singola molecola, considerando addirittura ogni singolo periodo della vita. Inoltre, bisogna anche tenere conto che gli enzimi citocromo P450 sono presenti anche in altri organi e che il metabolismo dei farmaci potrebbe variare nei singoli organi in funzione del genere. Infine, si prospetta che i processi d’induzione siano genere-specifici, ad esempio la clearance della teofillina è maggiore nelle donne fumatrici rispetto alle donne non fumatrici, e che l’induzione è maggiore nelle femmine (200%) rispetto ai maschi (137%) 8. Questo aspetto si estende ai nutrienti, ai supplementi e ai rimedi botanici, e questo è importante per il loro grande uso. Inoltre, le differenze di genere nel metabolismo possono dipendere dall’etnia del soggetto in questione. Le differenze farmacocinetiche riguardano anche l’escrezione renale: i processi di filtrazione glomerulare sono infatti influenzati dal peso ma, anche dopo la sua correzione, la velocità di filtrazione è minore del 10% nelle donne rispetto agli uomini (a questo si attribuisce, ad esempio, la differente clearance della digossina che risulta essere del 12-14% più bassa nella femmina rispetto al maschio). Poco si sa in merito alle differenze di genere a livello dei trasportatori renali e di altri organi, ma i pochi lavori sull’argomento sembrano suggerire differenze anche a questo livello.
Donne e ADRs
Le donne hanno un rischio maggiore (1,5-1,7 volte) di sviluppare ADRs. Pirmohamed et al. 9 hanno anche evidenziato che il 59% dei ricoveri dovuto a ADRs è a carico dalle donne. Probabilmente alla maggior gravità e alla maggiore frequenza delle ADRs concorrono tutta una serie di fattori come:
-
una particolare suscettibilità femminile (come nel caso torsades de point, aritmia ventricolare che può essere indotta da numerosi agenti farmacologici, inclusi medicinali di largo consumo quali antiaritmici, antibiotici, antistaminici, antipsicotici, antifungini azolici ecc.);
-
la politerapia, che è più frequente nelle donne (basta pensare che un 1/3 della popolazione femminile in età fertile utilizza associazioni estro-progestiniche come anticoncezionali orali, oltre alle donne anziane);
-
il dosaggio individuato per soggetti di sesso maschile di 70 kg;
-
le fluttuazioni ormonali che caratterizzano la vita riproduttiva femminile;
-
la carenza di studi clinici nelle donne. Non è possibile, infatti, sapere se un farmaco sia efficace e sicuro nelle donne in assenza di studi. Si arriverà a tale conoscenza solo dopo la commercializzazione del farmaco e gli eventuali eventi avversi, nelle donne, saranno scoperti solo più tardivamente, con un costo sociale certamente maggiore.
In particolare, oltre alla maggiore suscettibilità delle donne a sviluppare la sindrome del QT lungo, sono state descritte ADRs che colpiscono prevalentemente le donne come le fratture a livello degli arti in seguito a terapia con tiazolidindioni 10. I risultati di questo studio hanno poi portato a un warning da parte della FDA. In altri casi si è osservata invece una maggiore incidenza delle stesse ADRs come le fratture in corso di terapia con corticosteroidi ad alto dosaggio nei trapiantati di fegato 11; le alterazioni metaboliche (aumento di peso, alterazioni metaboliche ematiche) sono più frequenti nelle donne (37%) rispetto agli uomini in corso di terapia con acido valproico e antipsicotici 12, 7. Ciò significa che le donne possono andare incontro più facilmente a insulino-resistenza, alla non-alcoholic fatty liver disease, a malattie cardiovascolari e a una maggiore interruzione della terapia. Inoltre, le donne con AIDS-HIV (ricordiamo che in molti paesi il numero delle donne affette da HIV è superiore rispetto a quello degli uomini), in seguito a terapia con inibitori nucleosidici e non della transcriptasi inversa, vanno più facilmente incontro a ADRs come l’acidosi lattica e a reazioni epatiche. Inoltre, la nevirapina dà luogo a più reazioni cutanee nelle donne, mentre gli inibitori delle proteasi determinano un maggior rischio di disturbi metabolici nel sesso femminile 6. Le donne sono maggiormente soggette a depressione respiratoria in seguito a terapia con analgesici oppioidi 13. In effetti, i risultati di 8 studi clinici indicano che la dose di morfina necessaria per avere una risposta analgesica è minore nelle donne (60%) rispetto a quella necessaria per gli uomini 13. Tali differenze non riguardano solamente gli agonisti dei recettori μ, ma si estendono agli agonisti dei recettori K come pentazocina, nalbufina e butorfanolo, che risultano più efficaci nella donna 14 rispetto all’uomo.
Conclusioni
Quelle che abbiamo appena espresso rappresentano solo una parte delle problematiche connesse all’uso dei farmaci nella donna, che troveranno una giusta collocazione solo se le donne saranno incluse negli studi clinici che dovranno anche prevedere un’analisi genere-mirata. Sebbene appaia utopistico ottenere uguali outcome nella donna e nell’uomo, considerate le differenze esistenti, non è invece fallimentare raggiungere l’equità di genere nel campo degli outcome e cioè offrire a tutti i generi il miglior outcome possibile.
Bibliografia
-
Banchieri R. Il genere e la salute. Quaderni SIF 2008;13:1-12.
-
Legato MJ. Principles of gender-specific medicine. 1st ed. San Diego: Elselvier Academic Press 2004: 1396.
-
Franconi F, Brunelleschi S, Steardo L, Cuomo V. Gender differences in drug responses. Pharmacol Res 2007;55:81-95.
-
Ding EL, Powe NR, Manson JE, Sherber NS, Braunstein JB. Sex differences in perceived risks, distrust, and willingness to participate in clinical trials: a randomized study of cardiovascular prevention trials. Arch Intern Med 2007;167:905-12.
-
Anderson GD. Sex and racial differences in pharmacological response: where is the evidence? Pharmacogenetics, pharmacokinetics, and pharmacodynamics. J Womens Health (Larchmt) 2005;14:19-29.
-
Mattisson DR, Mattison Faye AC. Sex differences in drug development. Blickpunkt der Mann 2008;6:21-5.
-
Mencacci C, Cerveri GC. Antipsicotici e genere. Quaderni SIF 2007;11:8-14.
LI>
Gorski JC, Vannaprasaht S, Hamman MA, Ambrosius WT, Bruce MA, Haehner-Daniels B, et al. The effect of age, sex, and rifampin administration on intestinal and hepatic cytochrome P450 3A activity. Clin Pharmacol Ther 2003;74:275-87. -
Pirmohamed M, James S, Meakin S, Green C, Scott A, Walley T, et al. Adverse drug reactions as cause of admission to hospital: prospective analysis of 18,820 patients. BMJ 2004;329:15-9.
-
Murphy CE, Rodgers PT. Effects of thiazolidinediones on bone loss and fracture. Ann Pharmacother 2007;41:2014-8.
-
Shah SH, Johnston TD, Jeonm H, Ranjan D. Effect of chronic glucocorticoid therapy and the gender difference on bone mineral density in liver transplant patients. J Surg Res 2006;135:238-41.
-
El-Khatib F, Rauchenzauner M, Lechleitner M, Hoppichler F, Naser A, Waldmann M, et al. Valproate, weight gain and carbohydrate craving: a gender study. Seizure 2007;16:226-32.
-
Pleym H, Spigset O, Kharashi ED, Dale O. Gender differences in drug effects: implications for anesthesiologists. Acta Anaesthesiol Scand 2003;47:241-59.
-
Gear RW, Miaskowski C, Gordon NC, Paul SM, Heller PH, Levine JD. The kappa opioid nalbuphine produces gender and dose-dependent analgesia and antianalgesia in patients with postoperative pain. Pain 1999;83:339-45.



