Area Osteo-Mioarticolare [Numero 16. Settembre 2013] Guida clinica alla prevenzione e al trattamento dell’osteoporosi – (2° Parte) |  |
Raccomandazioni generali per tutti i pazienti
Per ridurre il rischio di frattura nella popolazione in genere, molte sono le strategie attuabili:
| Per ridurre il rischio di frattura nella popolazione in genere, molte sono le strategie attuabili: | |
| 1 | raccomandare un adeguato apporto di calcio e vitamina D con la dieta |
| 2 | controllare il peso corporeo |
| 3 | consigliare esercizi adeguati di potenziamento muscolare |
| 4 | eliminare i fattori di rischio modificabili quali fumo, abuso di alcol, rischi ambientali di cadute, correggere altri fattori di rischio quali disturbi della vista. |
Adeguato apporto di calcio e vitamina D
Provvedere un adeguato apporto di calcio e vitamina D è una maniera semplice e non costosa di aiutare a ridurre il rischio di frattura, come dimostrano molti trial clinici. Una dieta bilanciata, ricca di latticini a basso contenuto di grassi, frutta, verdura, è in grado di fornire sia il calcio che le sostanze necessarie a mantenere un buono stato di salute. Se non fosse possibile assumere il calcio necessario con la dieta, si raccomanda una supplementazione giornaliera sia per l’acquisizione del picco di massa ossea sia per il susseguente mantenimento dell’osso in condizioni di salute. Nel corpo umano, lo scheletro contiene il 99% della riserva di calcio: quando l’apporto esterno non è adeguato il tessuto osseo viene riassorbito per mantenere il calcio sierico a livelli costanti.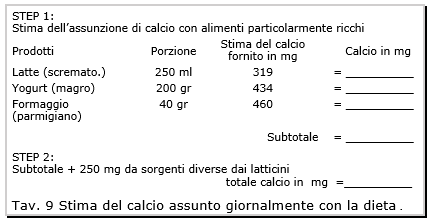
Il NOF avalla le raccomandazioni dell’ Institute of Medicine (IOM), secon-do le quali i maschi dai 50 ai 70 anni hanno necessità di 1.000 mg di cal-cio al giornomentre quelli oltre i 70 e le donne oltre i 50 anni di 1.200 mg.
L’assunzione in eccesso (dai 1.200 ai 1.500 mg) fornisce un beneficio limitato e potrebbe aumentare il rischio di calcoli renali, accidenti cardiovascolari e stroke. La letteratura scientifica ha atteggiamenti differenti in questo campo, ma non ci sono evidenze per asserire che l’assunzione del calcio a dosaggi superiori possa portare un rafforzamento supplementare dell’osso. La tavola 9 illustra un metodo semplice per la stima del contenuto in calcio nella dieta del paziente.
La Vitamina D giuoca un ruolo maggiore nell’assorbimento del calcio, nella salute dell’osso, nella performance muscolare , nell’equilibrio e nel rischio di caduta. Il NOF raccomanda l’assunzione di 800- 1000 U.I. di vitamina D al giorno per adulti di età superiore a 50 anni. L’apporto di vitamina D, consigliato dall’Institute of Medicine Dietary, è di 600 U.I. al giorno fino ai 70 anni e 800 U.I. per adulti di 71 anni e oltre.
La fonte principale di vitamina D include latte addizionato con vitamina D (400 U.I. per 250 ml), cereali, pesce d’acqua salata e fegato. Alcuni supplementi di calcio e complessi vitaminici contengono vitamina D. Possono essere utilizzate vitamina D2 e D3. La D2 deriva da sorgenti vegetali, idonea per individui strettamente vegetariani. Molti pazienti, inclusi quelli con sindromi da malassorbimento (celiaci ecc.) o altre patologie intestinali, insufficienza renale cronica, pazienti in trattamento con farmaci che aumentano il catabolismo della vitamina D (alcuni antiepilettici), pazienti confinati a casa, malati cronici e quelli con limitata esposizione al sole, individui con pelle molto scura, obesi, sono a rischio di carenza di vitamina D. Un alto indice di deficienza si nota sia nei pazienti con osteoporosi, specie in quelli con fratture d’anca, sia in coloro che sono in trattamento con farmaci antiosteoporotici. Poiché l’apporto di vitamina D richiesto per correggerne la carenza è variabile, dovrebbe essere dosato il 25(OH)D sierico in coloro che sono a rischio. La supplementazione raccomandata è quella che permette di raggiungere e mantenere il livello sierico di circa 30 ng/ml (75 nmol/L), specie in individui con osteoporosi. In alcuni pazienti il bisogno potrebbe essere superiore alle 800- 1000 U.I. giornaliere raccomandate, quindi il limite di sicurezza per la popolazione adulta è stato aumentato a 4000 U.I. nel 2010.
Trattamento della carenza di vitamina D
La deficienza di vitamina D negli adulti può essere trattata con 50.000 U.I. di vitamina D2 o D3 settimanali o con dosaggio giornaliero equivalente (6.000 U.I.), per 8- 12 settimane, in modo da raggiungere un livello ematico di 25(OH)D di circa 30 ng/ml. Questo regime dovrebbe essere seguito da una terapia di mantenimento di 1500–2000 U.I. al giorno. In individui obesi o con sindrome da malassorbimento o in coloro che assumono farmaci che influiscono sul metabolismo della vitamina D, potrebbe essere necessario un dosaggio maggiore per raggiungere e mantenere il livello ottimale.
Esercizi per il mantenimento del peso corporeo e per il potenziamento muscolare
Raccomandare l’attività fisica (camminare, Tai-Chi, jogging, salire le scale, ballare e giocare a tennis) per mantenere un adeguato peso corporeo e potenziare la muscolatura per ridurre il rischio di cadute e le fratture. Oltre ai benefici sullo stato di salute, l’esercizio fisico migliora l’agilità, la forza, la postura e l’equilibrio e aumenta moderatamente la densità dell’osso. Il NOF enfatizza l’attività fisica ad ogni età e per tutta la vita, poiché i benefici vengono persi quando l’individuo smette di muoversi. Prima di consigliare programmi di esercizio più duro, quali la corsa o il sollevamento pesi, è necessario un esame fisico accurato.
Prevenzione delle cadute
I rischi maggiori sono riportati nella tavola 2. Oltre che mantenere un adeguato livello di vitamina D e tenersi in attività, esistono altre strategie per scongiurare il rischio di cadere, quali stabilire e modificare il rischio individuale, il rischio domestico, e limitare gradualmente farmaci psicotropi. Correggere i deficit visivi potrebbe migliorare la mobilità ma aumentare il rischio di cadere, in caso di lenti multifocali.
Fumo di tabacco e eccessiva assunzione di alcol
L’uso di tabacco è deleterio per l’apparato scheletrico e la salute in genere. Il NOF incoraggia fortemente di smettere di fumare, e considera l’astensione dal fumo come uno degli interventi per la prevenzione dell’osteoporosi.
È necessario riconoscere e trattare i pazienti che abusano di alcol. Mentre quantità moderate non provocano effetti sull’osso, ma potrebbero addirittura migliorarne la densità e abbassare il rischio di frattura in post menopausa, quantità maggiori (tre o più drink al giorno) sono nocive per l’osso e possono aumentare il rischio di cadere.
Trattamento farmacologico
Tutti i pazienti candidati alla terapia dovrebbero essere informati sulla riduzione dei fattori di rischio e sull’importanza di calcio, vitamina D ed esercizio fisico come parte integrante di qualsiasi trattamento. Prima dell’inizio della terapia, il paziente dovrebbe essere valutato per cause di osteoporosi secondaria con rilievo di BMD mediante DXA centrale, quando possibile. L’approccio alla valutazione clinica del paziente viene schematizzato nella Tavola 7.
Le percentuali di riduzione del rischio di fratture, vertebrali e non, illustrate di seguito, sono quelle della FDA. In assenza di trial clinici, dovrebbe essere evitato il confronto di un farmaco rispetto ad un altro.
Candidati al trattamento
| Donne in post-menopausa e uomini di 50 anni e più che abbiano |
| • |
Una frattura d’anca o vertebrale (clinicamente manifesta o rilevata radiograficamene). Esistono evidenze palesi che, in pazienti con fratture pregresse trattati farmacologicamente, il rischio fratturativo futuro sia minore, per chi presenti un basso indice di massa ossea e per quelli con osteoporosi. |
| • |
Un T-score ≤ -2.5 al collo femorale, all’anca o al rachide lombare. Vi sono evidenze che dimostrano come i pazienti con osteoporosi abbiano un rischio elevato di frattura e un rischio fratturativo ridotto se sottoposti a farmacoterapia. |
| • |
Bassa massa ossea (T-score tra -1.0 e -2.5 al collo femorale o al rachide lombare) e probabilità di frattura d’anca a 10-anni di ≥3% o probabilità a 10-anni di frattura osteoporotica maggiore di ≥20% in base all’algoritmo WHO adattato agli USA. |
|
Approccio clinico alla gestione dell’osteoporosi in post-menopausa e in maschi di 50 o più anni di età. Principi generali: |
|
| • |
Raccogliere una storia dettagliata sui fattori di rischio per fratture osteoporotiche e cadute |
| • |
Eseguire l’esame fisico e richiedere gli esami diagnostici per valutare segni o cause secondarie di osteoporosi |
| • |
Modificare dieta /supplementi e altri fattori di rischio clinico per fratture |
| • |
Stimare a 10-anni la probabilità di frattura d’anca o altre fratture maggiori correlate ad osteoporosi utilizzando il FRAX |
| • |
Decidere chi e come trattare in base al giudizio clinico utilizzando questa Guida e tutte le informazioni cliniche disponibili. |
|
Tav. 10 |
|
| Prendere in considerazione terapie approvate dalla FDA in base a: |
| • |
fratture vertebrali (cliniche o asintomatiche) o frattura d’anca |
| • |
DXA (collo femorale o anca) o rachide lombare con T-score ≤ -2.5 |
| • |
bassa massa ossea (osteopenia) e probabilità a 10 anni di frattura d’anca ≥3% o di altra frattura maggiore osteoporotica ≥20% |
| • |
Le preferenze del paziente potrebbero essere un’indicazione al trattamento anche con probabilità di frattura a 10 anni che non coincidono con questi livelli |
| Considerare interventi terapeutici non farmacologici: |
| • |
Modificare i fattori di rischio di cadute |
| • |
Considerare la richiesta di valutazione per terapia fisica e/o occupazionale) |
| • |
Training su potenziamento muscolare ed equilibrio. |
| Follow-up: |
| • |
Pazienti che non richiedono terapie mediche alla prima valutazione dovrebbero essere rivalutati periodicamente |
| • |
Pazienti in trattamento farmacologico dovrebbero essere rivalutati con densitometria ogni due anni o più spesso quando clinicamente appropriato. |
| • |
Radiografie vertebrali dovrebbero essere ripetute in caso di diminuzione di altezza, nuovo dolore lombare, variazioni posturali o rilievi sospetti in radiografie toraciche |
| • |
Regolarmente, almeno ogni anno, rivedere la compliance al regime terapeutico |
Farmaci per l’osteoporosi approvati dalla FDA
Attualmente le opzioni farmacologiche per la prevenzione/trattamento dell’osteoporosi in post-menopausa includono, in ordine alfabetico: bifosfonati (alendronato, alendronato con vitamina D, ibandronato, risedronato e acido zoledronico), calcitonina, estrogeni (estrogeni e/o terapia ormonale). estrogeno agonisti/antagonisti (raloxifene), paratormone, teriparatite e l’inibitore RANKL denosumab. I benefici antifratturativi dei farmaci approvati dall’FDA sono stati studiati principalmente nell’osteoporosi post-menopausale, mentre vi sono dati limitati per quanto riguarda l’osteoporosi indotta da glucocorticoidi e l’osteoporosi maschile. I trattamenti approvati dalla FDA hanno dimostrato di ridurre il rischio fratturativo in pazienti con fragilità ossea e osteoporosi rivelata da DXA.
La farmacoterapia può ridurre le fratture anche in pazienti con bassa massa ossea (osteopenia) in assenza di fratture, anche se l’evidenza è meno forte. Pertanto il medico dovrà valutare caso per caso i potenziali benefici e rischi della terapia e l’efficacia di essa sulla riduzione del rischio di fratture vertebrali e non. È da notare che la soglia dell’intervento non considera i benefici non a carico dello scheletro né i rischi associati all’uso dello specifico farmaco. Il NOF sconsiglia l’utilizzo di farmaci non approvati dalla FDA. Alcuni di questi farmaci sono compresi nella Tavola 11, a solo titolo informativo.
Bifosfonati. Efficacia:
Alendronato
L’Alendronato sodico è approvato per la prevenzione (compresse da 5 mg al giorno o 35 mg settimanali) e il trattamento (10mg al giorno o 70 mg settimanali con 2.800 U.I. o 5.600 U.I. di vitamina D3) dell’osteoporosi post-menopausale, per aumentare la massa ossea in maschi con osteoporosi e per il trattamento di ambo i sessi in terapia con glucocorticoidi. L’alendronato riduce l’incidenza di fratture vertebrali e dell’anca di circa il 50% in tre anni in pazienti con o senza pregresse fratture.
Ibandronato
L’ibadronato sodico è approvato dalla FDA per il trattamento (150mg al mese o 3 mg ogni tre mesi in somministrazione e.v.) dell’osteoporosi post-menopausale. La preparazione orale è stata approvata anche nella prevenzione dell’ osteoporosi post-menopausale. L’ibadronato riduce l’incidenza di fratture vertebrali di circa il 50% in tre anni, ma non c’è documentazione sulla riduzione del rischio di fratture non vertebrali
Risedronato
Il risedronato sodico è approvato dalla FDA per la prevenzione e il trattamento dell’osteoporosi post-menopausale , per aumentare la massa ossea in maschi con osteoporosi e nella prevenzione e trattamento di osteoporosi in entrambi i sessi candidati o in terapia con glucocorticoidi. Il risedronato riduce l’incidenza di fratture vertebrali di circa 41-49% e di circa il 36% le fratture non vertebrali in un periodo di tre anni, con una significativa riduzione del rischio già dopo un annodi trattamento in pazienti con pregresse frattura vertebrali.
Acido zoledronico
L’acido zoledronico è approvato dalla FDA per la prevenzione e il trattamento (5 mg in infusione endovenosa lenta, almeno 15 minuti, ogni anno per il trattamento e ogni due anni per la prevenzione) dell’osteoporosi post-menopausale. Approvato anche per aumentare la massa ossea in maschi con osteoporosi e in entrambi i sessi che intraprendano terapia con glucocorticoidi per almeno 12 mesi. L’acido zoledronico è anche indicato per la prevenzione di nuove fratture cliniche in pazienti di entrambi i sessi che abbiano riportato di recente una frattura di anca dovuta a trauma non significativo (osteoporosi correlata). L’acido zoledronico riduce di circa il 70% l’incidenza di fratture vertebrali (con significativa riduzione ad un anno) , di circa il 41% le fratture di anca e del 25% in tre anni le fratture non vertebrali.
Somministrazione dei farmaci
Le compresse di alendronato e risedronato devono essere assunte al mattino, a stomaco vuoto, con abbondante acqua (non altri liquidi) a temperatura ambiente. Il risedronato a lento rilascio va invece assunto immediatamente dopo colazione con abbondante acqua. Dopo l’assunzione del farmaco, per almeno mezz’ora prima di mangiare, bere o assumere qualsiasi altro farmaco , il paziente non deve sdraiarsi ma rimanere seduto o in piedi.
L’ibandronato va assunto a stomaco vuoto, con abbondante acqua, e il paziente dovrà attendere 60 minuti prima di mangiare, bere o assumere altri farmaci, restando in piedi o seduto. La formulazione endovenosa va assunta ogni tre mesi, previo controllo della creatininemia prima di ogni somministrazione.
L’acido zoledronico, 5 mg in 100 ml, viene somministrato una volta l’anno o ogni due anni mediante infusione endovenosa lenta (almeno 15 minuti). Il paziente può essere pretrattato con paracetamolo per ridurre il rischio di effetti collaterali (artralgie, cefalea, mialgie ecc), sintomi riportati nel 32% dei pazienti dopo la prima somministrazione, 7% dopo la seconda e 3% dopo la terza.
Sicurezza dei farmaci
Gli effetti collaterali dei bifosfonati sono comuni a tutti quelli assunti oralmente e includono problemi gastrointestinali quali difficoltà alla deglutizione, esofagite, ulcera gastrica.
Tutti i bifosfonati possono influire sulla funzionalità renale e sono controindicati in pazienti con GFR sotto i 30-35 ml/min. L’acido zoledronico è controindicato in pazienti con clearance della creatinina minore di 35ml/min o in pazienti con evidenza di insufficienza renale. I pazienti dovrebbero quindi essere esaminati prima della somministrazione di acido zoledronico per escludere quelli a rischio. La clearance della creatinina dovrebbe essere eseguita prima di ogni somministrazione. È stata riportata osteonecrosi della mandibola, non comune alle dosi terapeutiche di questi farmaci ma frequente dopo somministrazione e.v. di alti dosaggi di bifosfonati utilizzati nel trattamento di pazienti oncologici. Il livello di rischio di osteonecrosi della mandibola non è noto nei pazienti trattati con bifosfonati per l’ osteoporosi, ma sembra trascurabile per almeno 5 anni, rischio che tende però ad aumentare per trattamenti protratti nel tempo. Possono verificarsi congiuntivite, e, sebbene raramente, fratture femorali sub trocanteriche e diafisarie da trauma minore, associate all’uso di bifosfonati a lungo termine (per oltre i 5 anni). Queste fratture inusuali sono precedute da dolore nell’area della coscia o dell’inguine , pertanto I pazienti dovrebbero essere valutati per questo rischio.
Calcitonina
Efficacia:
La calcitonina di salmone è stata approvata dalla FDA per il trattamento dell’osteoporosi in donne in menopausa da almeno 5 anni. Essa riduce il verificarsi delle fratture vertebrali del 30% in coloro che abbiano pregresse fratture vertebrali ma non ci sono evidenze per quanto riguarda altre fratture.
Somministrazione:
200 U.I. somministrate sotto forma di spray nasale come singola dose giornaliera. È disponibile anche la formulazione in fiale s.c.
Sicurezza:
La somministrazione intranasale può essere causa di rinite, epistassi, reazioni allergiche, specie in coloro con storia di allergia al salmone. Attualmente la FDA ha in corso una revisione dei dati post marketing a lungo termine sulla calcitonina e probabilmente vi saranno nuove informazioni sulla prescrivibilità di questo farmaco
Estrogeni/Terapia ormonale (ET/HT)
Efficacia:
La terapia ormonale è approvata dalla FDA per la prevenzione dell’osteoporosi, attenuazione dei sintomi vasomotori ed atrofia vulvovaginale associati alla menopausa. Le donne non isterectomizzate necessitano di TOS , contenente anche progestinico per la protezione della rima endometriale.
La Woman’s Health Initiative (WHI) ha evidenziato che terapie ormonali protratte per 5 anni riducono il rischio di fratture cliniche vertebrali e d’anca del 34% e del 23% altre fratture osteoporotiche.
Somministrazione:
L’ ET/HT è disponibile in un’ampia varietà di formulazioni orali: solo estrogeni, solo progestinici, o in combinazioni estro-progestiniche. I dosaggi possono essere ciclici, sequenziali o continui. Se e qualora il trattamento venisse interrotto, la perdita di osso potrebbe essere rapida, pertanto vanno presi in considerazione altri farmaci per mantenere la BMD.
Sicurezza:
La Women’s Health Initiative (WHI) ha evidenziato aumento del rischio di infarto miocardico, stroke, tumori invasivi della mammella, embolia polmonare e trombosi venosa profonda durante I 5 anni di trattamento con estrogeni e medrossiprogesterone. Analisi successive hanno mostrato che non esiste aumento del rischio cardiovascolare se il trattamento viene iniziato a 10 anni dalla menopausa, e, nella formulazione con solo estrogeno, non si evidenzia aumentato rischio del tumore mammario in 7,1 anni di trattamento. Non sono stati studiati altri dosaggi o combinazioni di estrogeno e progestinico, pertanto, in assenza di dati, bisogna ritenere che il rischio sia equiparabile.
Ne deriva che l’ET/HT dovrebbe essere utilizzata ai dosaggi minimi efficaci e per il tempo minimo necessario per trattare sintomi menopausali da moderati a severi.
Per la sola prevenzione dell’osteoporosi, La FDA raccomanda di considerare attentamente l’utilizzo di altri farmaci
Agonisti/antagonisti estrogeni (modulatori selettivi del recettore estrogenico SERM): Raloxifene
Efficacia:
Il raloxifene è approvato dalla FDA sia per la prevenzione che per il trattamento dell’osteoporosi in post-menopausa. Riduce il rischio di fratture vertebrali del 30% in pazienti con precedente frattura vertebrale e del 55% in assenza di fratture, per un periodo di 3 anni di trattamento. Non sono documentate riduzione del rischio per quanto riguarda altre fratture. Il raloxifene è indicato nella riduzione del rischio di tumore mammario invasivo in donne in post-menopausa con osteoporosi. Esso non riduce il rischio di malattie coronariche.
Somministrazione:
Disponibile in compresse da 60 mg, da assumere una volta al giorno prima o dopo i pasti
Sicurezza:
L’aumento del rischio di trombosi venosa profonda è paragonabile a quello degli estrogeni. Può anche peggiorare le vampate di calore.
Ormone paratiroideo Teriparatide
Efficacia:
PTH(1-34), teriparatide, è approvato dalla FDA per il trattamento dell’osteoporosi post-menopausale e in maschi con alto rischio fratturativo, in entrambi i sessi ad alto rischio di frattura legato ad osteoporosi da assunzione di glucocorticoidi e per aumentare la massa ossea in maschi con osteoporosi ad alto rischio di frattura associata ad ipogonadismo. Riduce il rischio di fratture vertebrali del 65% e del 53% il rischio di fratture non vertebrali in pazienti con osteoporosi dopo un periodo medio di 18 mesi di trattamento.
Somministrazione:
L’ormone paratiroideo è un agente anabolizzante (costruttore di osso) e si somministra una volta al giorno per iniezione sottocutanea in dose di 20 μg . Dopo l’interruzione del trattamento la perdita ossea può essere rapida, quindi vanno considerati agenti alternativi
Sicurezza:
Gli effetti collaterali di Teriparatide includono crampi, nausea, vertigini. Siccome, in dosi elevate e per lunghi periodi di trattamento, è stato osservato un aumento dell’incidenza di osteosarcoma nel ratto, pazienti con aumentato rischio di osteosarcoma (ad es. malattia di Paget ossea) o con pregressa terapia radiante dello scheletro o ipercalcemia o metastasi o malignità ossea non dovrebbero assumere Teriparatide. La sicurezza e l’efficacia non è stata dimostrata in trattamenti protratti oltre i due anni, pertanto questo è il limite massimo del suo impiego. Nella pratica comune il trattamento con Teriparatide viene seguito da agenti anti-riassorbimento, usualmente un bifosfonato, per mantenere o incrementare la BMD.
Denosumab: attivatore del fattore nucleare Kappa-B(RANK) Ligand (RANKL)/ RANKL Inibitore: anticorpo monoclonale umanizzato in grado di neutralizzare il RANKL, una citochina che, interagendo con il recettore RANK sulla membrana di pre-osteoclasti e osteoclasti maturi, ne condiziona reclutamento, maturazione e sopravvivenza. In numerose condizioni dove abbiamo perdita di massa ossea vi è uno squilibrio tra il RANKL (attivatore osteoclastico) che risulta aumentato e l’OPG o Osteoprotegerina (inibitore osteoclastico)
Efficacia:
Denosumab è approvato dalla FDA per il trattamento dell’osteoporosi in donne in post-menopausa ad alto rischio di frattura. Riduce l’incidenza di fratture vertebrali di circa il 68%, di fratture d’anca del 40% e di altre fratture del 20% in un periodo di tre anni di trattamento. Denosumab è altresì indicato per aumentare la massa ossea in maschi ad alto rischio di frattura, nel trattamento di donne con cancro della mammella e nel trattamento della perdita ossea in maschi con cancro della prostata trattato con alcuni farmaci .
Somministrazione:
Deve essere somministrato da personale medico, 60 mg per via sottocutanea ogni sei mesi
Sicurezza:
Può causare ipocalcemia, che deve essere corretta prima di iniziare il trattamento. Aumenta il rischio di infezioni cutanee (cellulite) e d eritemi. Denosumab è stato anche associato ad osteonecrosi della mandibola sia nel trattamento dell’osteoporosi sia nel trattamento del cancro, anche se in quest’ultimo setting appare più evidente. È inoltre associato a fratture di femore atipiche. Alla sospensione del trattamento la perdita ossea può essere rapida e bisogna prendere in considerazione altri trattamenti per conservare la BMD.
Terapia sequenziale e combinata
In genere è preferibile una terapia sequenziale con anabolizzanti seguita da agenti antiriassorbimento. La terapia combinata con teriparatide e un agente antiriassorbimento può essere presa in considerazione in pochi setting clinici, in pazienti con osteoporosi severa. Esistono poche indicazioni all’utilizzo di due trattamenti antiriassorbimento anche se questa opzione potrebbe essere considerata nel breve periodo per donne con attiva perdita di osso quando già in trattamento con terapia ormonale a basso dosaggio per la sindrome menopausale o con raloxifene per la prevenzione deli tumore mammario.
Durata del trattamento
Nessuna terapia farmacologica dovrebbe durare indefinitamente. Tutti i farmaci non-bifosfonati producono effetti temporanei che svaniscono dopo la sospensione. Se essi vengono interrotti, i benefici spariscono rapidamente mentre con i bifosfonati essi perdurano anche dopo la sospensione.
Le evidenze di beneficio oltre i cinque anni di trattamento sono limitati, mentre i timori per fratture atipiche di femore e osteonecrosi della mandibola aumentano dopo i cinque anni. Anche se non ci sono larghe evidenze come guida alla durata del trattamento,sembra ragionevole interrompere la terapia con bifosfonati dopo 3-5 anni negli individui che mostrano un modesto rischio di frattura dopo il periodo di trattamento iniziale, mentre, per quelli ad alto rischio, bisogna considerare la continuazione del trattamento con bifosfonati o con altro farmaco. Poiché non esistono raccomandazioni valide per ogni paziente sulla durata della terapia, la decisione deve essere individualizzata, ricalcolando il rischio fratturativo dopo i 3-5 anni dall’inizio della terapia e tenendo in considerazione la storia clinica, specie rispetto a fratture intercorse nel periodo, nuove malattie croniche e nuovi trattamenti, così come va determinata la misura dell’altezza, la BMD e l’integrità vertebrale se si sono evidenziate riduzioni di altezza durante il periodo di trattamento.
Farmaci per l’osteoporosi non approvati dalla FDA
| Farmaci elencati solo per informazione. Essi includono: |
| • |
Calcitriolo. Analogo sintetico della Vitamina D, promuove l’assorbimento del calcio, approvato dalla FDA per ipocalcemia e malattie ossee metaboliche in pazienti in dialisi, nell’ipoparatiroidismo sia chirurgico che idiopatico, e nello pseudoparatiroidismo. Non esistono dati affidabili che dimostrino il suo effetto sulla riduzione del rischio fratturativo osteoporotico. |
| • |
Genisteina. Isoflavone, fitoestrogeno, integratore considerato sicuro dalla FDA. Potrebbe dare benefici sulla salute dell’osso in post-menopausa ma sono necessari ulteriori studi per capire appieno I suoi effetti sulla salute dell’osso e sul rischio di frattura |
| • |
Altri bifosfonati. Etidronato, pamidronato, tiludronato, nella stessa classe di alendronato, ibandronato, risedronato e zoledronato, ma variano nella struttura chimica. Nessuno di essi è approvato fino ad ora per la prevenzione e il trattamento dell’osteoporosi, anche se la maggior parte di essi è approvata per altre patologie (M. di Paget, ipercalcemia in condizioni oncologiche, miosite ossificante) |
| • |
PTH(1-84). Approvato in alcuni paesi europei per il trattamento dell’osteoporosi nella donna. Uno studio clinico ha dimostrato che il PTH(1-84) riduce il rischio di fratture vertebrali al dosaggio di 100mcg/d. |
| • |
Sodio fluoruro. Attraverso un processo tuttora non chiaro, stimola la formazione di nuovo osso, anche se la qualità di esso è incerta e l’evidenza della riduzione del rischio di frattura è controversa. |
| • |
Ranelato di stronzio. Farmaco approvato in alcuni paesi europei per il trattamento dell’osteoporosi. Riduce il rischio di fratture vertebrali e non, ma il meccanismo d’azione non è chiaro. L’incorporamento dello stronzio nella struttura cristallina a rimpiazzare il calcio potrebbe essere parte del suo meccanismo d’azione, effetto documentato solo per il prodotto farmaceutico Servier. Questo effetto non è stato studiato adeguatamente per i supplementi nutrizionali che contengono sali di stronzio. |
| • |
Tibolone. Steroide sintetico estrogeno-simile che potrebbe prevenire la perdita di massa ossea e ridurre i sintomi menopausali senza stimolare il tessuto mammario e uterino. In Europa è indicato per il trattamento dei sintomi vasomotori della menopausa e nella prevenzione dell’osteoporosi, ma non è approvato per l’uso in USA. |
| Tav. 10 | |
Monitoraggio dell’efficacia dei farmaci.
È importante chiedere al paziente se stia assumendo i farmaci ed incoraggiare la compliance alla terapia per poter ridurre il rischio di frattura. È inoltre appropriato rivedere i fattori di rischio, ed incoraggiare un adeguato apporto di calcio e vitamina D, attività fisica e stili di vita appropriati. Il bisogno di trattamento per l’osteoporosi dovrebbe essere rivalutato annualmente e la durata di esso individualizzata. Alcuni pazienti potranno sospendere la terapia dopo qualche anno di trattamento, specie se con bifosfonati, altri dovranno continuare più a lungo. In caso di interruzione, bisognerà valutare periodicamente il rischio di fratture, di caduta, qualsiasi malattia sopravvenuta,la BMD e, quando possibile, i markers biochimici.
Il rilievo accurato dell’altezza del paziente, annualmente, è un parametro fondamentale per giudicare l’efficacia della terapia. Pazienti che perdono 2 cm o più dovrebbero ripetere una radiografia vertebrale per determinare se si sono verificate fratture ulteriori dopo l’ultima visita. La DXA per monitorare il paziente dovrebbe essere ripetuta in base alla necessità clinica, al responso atteso e in considerazione delle norme locali. Il NOF raccomanda di ripetere la BMD ogni due anni, in accordo con le linee guida Medicare, ma riconosce che test più frequenti sono giustificati in alcune situazioni cliniche. Per monitorare l’efficacia del trattamento possono essere utilizzati i seguenti esami:
DXA centrale (anca o rachide lombare) è il gold standard per giudicare serialmente la BMD. Le variazioni biologiche della densità ossea sono minime paragonate alla percentuale di errore del test, e l’interpretazione dello studio dell’osso dipende dalla stima delle più piccole variazioni nella BMD che è al di sotto della gamma di errore del test. Le differenze, insignificanti, variano col variare dello strumento utilizzato e della popolazione sottoposta a controllo, del sito di misurazione, della competenza dell’operatore nel posizionare il paziente e nell’analizzare i dati, e dall’intervallo di confidenza utilizzato. Differenze del 3-6% all’anca e del 2-4% alla colonna lombare da esame ad esame potrebbero essere dovute a errore di precisione del test stesso.
Informazioni su come stabilire la precisione del test e calcolare il margine di errore sono presenti su www.ISCD.org.
QCT. La BMD trabecolare del rachide lombare può essere utilizzata per monitorare le variazioni della BMD età-malattia/ trattamento correlata in entrambi i sessi.
Note: pDXA, pQCT e QUS. Siti scheletrici periferici non rispondono nella stessa misura della colonna e dell’anca alla terapia, pertanto non sono adatti al monitoraggio dell’efficacia di essa.
Marker biochimici del turnover osseo. La negativizzazione dei marker biochimici del turnover osseo dopo 3-6 mesi di terapia con agenti antiriassorbimento o l’aumento dei valori dopo 1-3 mesi di terapia anabolizzante, sono considerati in grado di predire il rischio di frattura indipendentemente dalla BMD, come dimostrano ampi trial clinici. Per essere clinicamente significative le variazioni dei marker biochimici in un individuo devono essere superiori al margine di errore. Il margine di errore è specifico per ogni marker utilizzato e viene calcolato moltiplicando l’errore di precisione di ciascuno dei marker specifici per 2,77 (95% del livello di confidenza). Le differenze biologiche si riducono negli esami eseguiti la mattina dopo una notte di digiuno. Misure seriali devono essere eseguite alla stessa ora e dallo stesso laboratorio.
Radiografie vertebrali. Dopo una prima radiografia vertebrale per rivelare eventuali fratture, ogni qualvolta i cambianti intervenuti nel paziente suggeriscano una nuova frattura ( rilievo di perdita di altezza, mal di schiena senza una diagnosi, variazioni posturali, o rilievo di deformità vertebrali in Rx torace essa deve essere ripetuta.
Medicina fisica e riabilitativa
Fisioterapia e riabilitazione possono ridurre la disabilità, migliorare la funzionalità e diminuire il rischio di cadute nei pazienti con osteoporosi oltre che migliorare la capacità di portare avanti le attività del vivere quotidiano. Anche fattori psicosociali incidono fortemente sulla capacità funzionale del paziente con osteoporosi.
Raccomandazioni tratte dalla “ Health Professional’s Guide to Rehabilitation of the Patient with Osteoporosi “
| • |
valutare e considerare lo stato fisico e funzionale del paziente così come lo stato sociale e psicologico, clinico, nutrizionale e l’assunzione di farmaci prima di prescrivere un programma riabilitativo. Enfatizzare uno stile di vita attivo, a iniziare dall’infanzia. |
| • |
valutare il paziente e le terapie in atto considerando possibili interazioni e rischio per alterazioni dello stato mentale . Intervenire (se il caso). |
| • |
educare il paziente con o ad alto rischio per osteoporosi a muoversi con prudenza nelle attività quotidiane e ad assumere una postura corretta. Intervenire adeguatamente se il caso ( es. Prescrizione di dispositivi per migliorare equilibrio e mobilità). |
| • |
Valutare l’ambiente per fattori di rischio di caduta e intervenire se il caso. |
| • |
Implementare l’andatura per correggere deficit sottostanti quando possibile ( migliorare postura ed equilibrio, potenziare i muscoli quadricipiti per permettere alla persona di sollevarsi da una sedia autonomamente, promuovere l’uso di dispositivi assistenziali per la marcia, l’equilibrio, il sollevamento e l’estensione. |
| • |
In base alle condizioni iniziali del paziente, raccomandare un programma di esercizi completo che includa attività aerobiche di carico sullo scheletro, educazione posturale, allenamento alla resistenza progressiva per il rafforzamento della muscolatura e delle ossa, stretching per contratture e mantenimento dell’equilibrio. |
| • |
seguire i principi che assicurano la sicurezza dei movimenti. Le attività quotidiane (lavori domestici, giardinaggio) sono modi pratici per contribuire al mantenimento della forma fisica e della massa muscolare. Inoltre, esercizi di resistenza progressivi e di carico, secondo le possibilità del paziente, sono di beneficio per la forza muscolare e ossea e riducono il rischio di cadere. |
| • |
consigliare al paziente di evitare di chinarsi o di esercitarsi col tronco flesso. |
| • | evitare l’immobilizzazione a lungo termine e raccomandare di stendersi a letto solo se necessario e per periodi brevi, intervallati da deambulazione e posizione seduta. |
| • | In pazienti con fratture vertebrali o dolore cronico in seguito a fratture vertebrali multiple, può essere di beneficio utilizzare corsetti, busti o utilizzare apparecchi per la postura, in modo da ridurre il carico sui siti fratturati e distendere la colonna, ma non per lunghi periodi per evitare di indebolire la muscolatura. |
| • | una gestione efficace del dolore è la pietra miliare nella riabilitazione delle fratture vertebrali. Il sollievo dal dolore si può ottenere con l’uso di una varietà di agenti fisici, farmacologici e comportamentali con l’attenzione ai rischi da effetti collaterali quali sedazione e disorientamento che potrebbero provocare cadute. |
| • | Individui con fratture vertebrali recenti dolorose, che non traggono beneficio da trattamenti conservativi, potrebbero essere candidati ad interventi di emergenza quali cifoplastica o vertebroplastica . |
Conclusioni e quesiti
| Questa Guida ha messo a fuoco prevenzione, diagnosi e trattamento dell’osteoporosi in donne in post- menopausa e maschi dai 50 anni e oltre, con le metodiche disponibili L’osteoporosi in questa popolazione non presenta segreti, ma esistono altri problemi che necessitano di ricerche cliniche epidemiologiche ed economiche. Ad esempio: |
| • |
Come possiamo stabilire la resistenza ossea usando tecnologie non invasive per l’identificazione dei pazienti ad alto rischio di frattura? |
| • |
È possibile massimizzare il picco di massa ossea in bambini, adolescenti e giovani adulti? |
| • |
Quali sono le caratteristiche di un programma di esercizi efficace (tipo, intensità, durata, frequenza) per la prevenzione e il trattamento? |
| • |
Cosa può essere fatto per identificare e modificare I fattori di rischio di cadute e quali potrebbero essere le conseguenze sulla popolazione a rischio? |
| • |
Quanto sono efficaci I diversi farmaci approvati dalla FDA nel prevenire fratture in pazienti con massa ossea moderatamente ridotta? |
| • |
Quali approcci risultano più efficaci nel trattamento dell’osteoporosi in disabili? |
| • |
Come diagnosticare più accuratamente fratture vertebrali non particolarmente severe? |
| • |
Quanto a lungo continuare terapie antiriassorbimento? Esistono effetti collaterali a lungo termine ancora non noti? |
| • |
Sono utili le terapie combinate, quali le combinazioni più utili, e per quanto tempo devono essere seguite? |
| • | Possiamo identificare agenti che potrebbero aumentare la massa ossea tanto da restituire l’integrità? |
| • |
Dovremmo trattare I pazienti fino al raggiungimento di un certo obiettivo , quindi riconsiderare tipo e dosaggio del farmaco? E quale dovrebbe essere questo obiettivo? |
| • |
Quale agente terapeutico prescrivere nella terapia sequenziale per massimizzare il beneficio e minimizzare il rischio nell’arco della vita del paziente? |
Il NOF è impegnato a continuare gli sforzi per dare una risposta a queste domande con l’obiettivo di eliminare la minaccia dell’osteoporosi sulla salute delle generazioni presenti e future.
Commento del revisore
Pur non essendo vere e proprie linee guida (manca una revisione sistematica delle evidenze e il grading delle raccomandazioni proposte), i suggerimenti contenuti in questo lavoro ne condividono l’affidabilità, ponendosi come punti di riferimento per decisioni cliniche. Il NOF (National Osteoporosis Foundation) conta oggi 98 società scientifiche associate appartenenti a 57 Paesi. In rete è possibile consultare i report annuali che riassumono le attività della fondazione e gli articoli realizzati dalla stessa e pubblicati nella rivista Osteoporosis International.
Importanza per la medicina generale
Se, come medici di medicina generale, ci occupiamo di prevenzione, siamo molto attenti affinchè i nostri pazienti modifichino i loro stili di vita per evitare condizioni quali cancro, malattie cardiovascolari, BPCO ecc. Magari la salute delle loro ossa non ci sembra meritevole di un posto in evidenza nelle nostre priorità, visto che in genere ci occupiamo di osteoporosi su indicazione dello specialista o magari dopo una frattura.
Le fratture osteoporotiche hanno importanti implicazioni sociali ed economiche oltre che sanitarie. I pazienti con frattura del femore prossimale presentano, entro un anno dalla frattura, un tasso di mortalità del 15-30%. Tra gli anziani le fratture osteoporotiche rappresentano una delle maggiori cause di mortalità, con una incidenza sostanzialmente sovrapponibile a quella per ictus e carcinoma mammario e 4 volte superiore a quello per carcinoma endometriale. Il 50% dei pazienti con
frattura di femore presenta inoltre una consistente riduzione del livello di autosufficienza e, in circa il 20% dei casi, richiede una istituzionalizzazione.
L’osteoporosi, come è stato detto, “it’ beatable, it’s treatable” ed è il medico di medicina generale che meglio di chiunque altro può contribuire all’identificazione capillare dei soggetti a maggiore
rischio di frattura, attraverso la ricerca sistematica dei fattori di rischio clinico, l’approfondimento diagnostico e, quando è richiesta una terapia, a essere nella posizione migliore per condividere con il paziente la scelta terapeutica e motivarlo a un’aderenza ottimale alle cure.



