Area Dolore – Cure Palliative [Numero 52 – Articolo 2. Maggio 2011] Dolore Centrale post-ictus: uno studio di popolazione |  |
Dopo un ictus si può avere dolore di diverso tipo come il dolore della spalla emiplegica, il dolore da spasticità, il mal di testa, il dolore articolare e un tipo particolare di dolore definito come “dolore centrale post-ictus ( Central post stroke pain: CPSP ).
Sebbene la presenza di dolori dopo un ictus sia comune, il CPSP è spesso misconosciuto come conseguenza di un ictus cerebrale, con un impatto negativo sulla qualità di vita di questi pazienti, già gravati da importanti disturbi come i deficit motori, latassia, e lafasia.
Il CPSP è una condizione particolare in cui il dolore è dovuto alla lesione delle vie del dolore e definita in precedenza come “sindrome dolorosa neuropatica conseguente a un ictus, caratterizzata da dolore e alterazioni della sensibilità in quelle parti del corpo che corrispondono alla zona di lesione cerebrovascolare, se non sono presenti evidenti cause di dolore nocicettivo, psicogeno o neuropatico periferico.
Una nuova classificazione del dolore neuropatico definisce il CPSP come “dolore che insorge quale diretta conseguenza di una lesione cerebrovascolare del sistema somatosensitivo, nel sistema nervoso centrale”.
Questa nuova definizione suscita diversi interrogativi sulla clinica e lepidemiologia del CPSP, rispetto agli altri tipi di dolore post- ictus. La ridotta soglia al dolore e/o alla temperatura, insieme allallodinia e alla disestesia nelle zone corporee interessate dal dolore, sono manifestazioni caratteristiche di dolore centrale. La perdita di sensibilità allo stimolo termico e alla puntura è dovuta a un danno delle vie spinotalamiche, mentre le manifestazioni dipersensibilità, come lallodinia e la disestesia, sono espressione d ipereccitabilità neuronale.
Gli obiettivi del presente studio sono: identificare i pazienti con CPSP in uno studio di popolazione utilizzando un questionario, verificare la diagnosi tramite un esame clinico e descrivere le caratteristiche del CPSP nei soggetti individuati.
Metodi
Reclutamento dei pazienti con ictus
I pazienti con ictus sono stati identificati nel Danish National Indicator Project Stroke Database (NIP), un database danese in cui sono stati registrati, sin dal gennaio 2003, tutti i pazienti ricoverati con una diagnosi di ictus, secondo i criteri ICD-10 della Organizzazione Mondiale della Sanità. Sono stati inclusi nello studio i pazienti con la diagnosi di emorragia cerebrale, infarto cerebrale e ictus d incerta origine. Nellottobre 2006 è stato spedito un questionario a tutti i pazienti, ancora in vita, registrati nel database della contea di Aarao, in Danimarca, dal marzo 2004 al febbraio 2005 (964). Ai soggetti che non hanno risposto, dopo un mese, è stato inviato un sollecito. Nei casi in cui le risposte al questionario non erano chiare o erano state omesse, i partecipanti erano contattati per telefono.
Disegno dello Studio
Il questionario comprendeva diverse domande: sui dati demografici, sullictus, sulla presenza di dolore e sensazioni anomali, sullinsorgenza di dolore cronico e sulla qualità di vita. Il dolore cronico era definito dalla presenza di dolore continuo o ricorrente per più di tre mesi. Ai pazienti veniva chiesto se il dolore cronico era insorto al momento dellictus o successivamente. La sezione del questionario sul dolore comprendeva domande di screening sulla presenza di mal di testa, dolore alla spalla, dolore ad altre articolazioni, dolore da spasmi o contratture muscolari, e altri “tipi di dolore. Ai partecipanti veniva inoltre chiesto di disegnare su apposite mappe corporee, le aree di sensazioni anomali e di “altri tipi di dolore. Venivano eliminati dallo studio i pazienti che negavano di aver avuto un ictus e i pazienti che non avevano potuto completare le domande sul dolore cronico. Le informazioni sulla diagnosi e sulla severità dellictus erano tratte dal database NIP.
Il sospetto di CPSP era posto mediante 4 criteri predefiniti del questionario e riportati nella tab.1
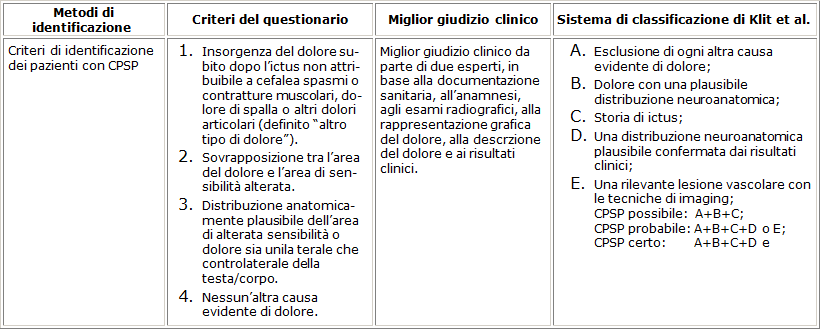
Tabella 1. Criteri diagnostici per lidentificazione dei casi CPSP “dolore centrale post-ictus”
Esame clinico
Tra maggio 2008 e giugno 2009 sono stati contattati tutti i pazienti che avevano soddisfatto i criteri del questionario; di questi, i pazienti con dolore o disestesia post-ictus o che non era stato possibile intervistare telefonicamente, furono invitati per un esame clinico che comprendeva unanamnesi generale, una rappresentazione su mappa corporea del dolore, unanamnesi standardizzata del dolore, la somministrazione della versione danese con 10 items del DN4, la valutazione dellinterferenza del dolore e un test della sensibilità. Il test della sensibilità valutava dettagliatamente la sensibilità, bilateralmente, al tatto, alla puntura, alla temperatura. Era annotata la presenza di disestesia o allodinia sia spontanea che evocata; veniva, inoltre, registrato larea e la massima intensità del dolore evocato e le alterazioni della sensibilità nellarea del dolore, utilizzando larto controlaterale come area di controllo. Infine per tutti pazienti sottoposti allesame clinico, erano acquisiti i dati clinici ed i referti delle TAC e RM effettuate durante il ricovero allinsorgenza dellictus.
Classificazione dei pazienti esaminati
Alla fine della raccolta dei dati, tutte le informazioni erano rese anonime e riesaminate, indipendentemente, da due esperti di dolore neuropatico e i pazienti erano classificati, sulla base del miglior giudizio clinico, come:
“CPSP certo, “CPSP probabile ( se non si potevano escludere altre cause di dolore ), “Disestesia tipo CPSP ( in caso di alterazioni della sensibilità senza dolore ), “CPSP da escludere. In caso di giudizio discordante, i due esperti concordavano un giudizio condiviso.
I pazienti esaminati erano poi valutati da un terzo autore che utilizzava un nuovo sistema di classificazione del dolore neuropatico, pubblicato da Treede et al., definito “sistema di classificazione ( Grading system ), che classifica il CPSP come “possibile, “probabile, “certo. (tab. 2)
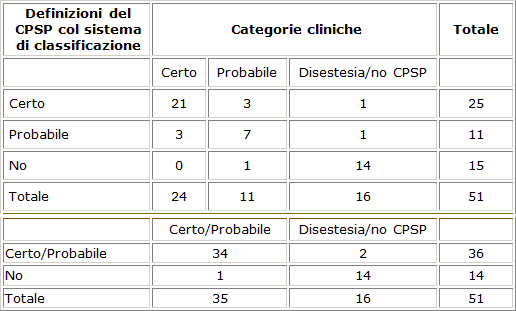
Tabella 2. Concordanza tra il miglior giudizio clinico e sistema di classificazione per CPSP
In caso di discordanza tra il giudizio clinico e la classificazione secondo Treede, tutti i dati disponibili venivano riesaminati ancora dai tre autori e veniva concordato un giudizio condiviso di classificazione ( Consensus Classification ).
Risultati
Sono stati restituiti 644 questionari dei 964 inviati e sono stati arruolati nello studio 608 pazienti con ictus (63.1%). I pazienti che soddisfacevano i 4 criteri predefiniti per sospetto CPSP sono stati 67, con unincidenza del 11% sul totale dei questionari compilati. Al follow-up, 12 dei 67 pazienti erano deceduti, in 2 pazienti il dolore si era risolto e 2 erano stati esclusi dallo studio, con un totale di 51 pazienti ( 24 uomini, 27 donne ) con sospetto CPSP sottoposti allesame clinico. Fig. 1

Figura 1. Studio Flowchart
In base al “miglior giudizio clinico sono stati definiti 24 pazienti come “CPSP certo, 10 come “CPSP probabile, 6 come “Disestesia tipo CPSP e 11 come “CPSP escluso. In 22 casi (43.1%) cera stato inizialmente un giudizio discordante tra gli esperti concluso con successivo giudizio concordato.
Con il grading system, 25 pazienti erano definiti come “CPSP certo, 11 come “CPSP probabile e 15 come “CPSP escluso. Così dei 51 pazienti individuati come possibili CPSP con il questionario, 36 (il 66.7% ) erano classificati come “CPSP certo o probabile nella valutazione clinica. Quindi secondo il giudizio condiviso di classificazione ( consensus classification ), 21 pazienti (41%) erano classificati come affetti da “CPSP certo, 14 (27%) come “CPSP probabile, 6 (12%) come “disestesia e 10 (20%) come “CPSP escluso.
Le caratteristiche demografiche dei pazienti esaminati sono riportate nella Tav. 3
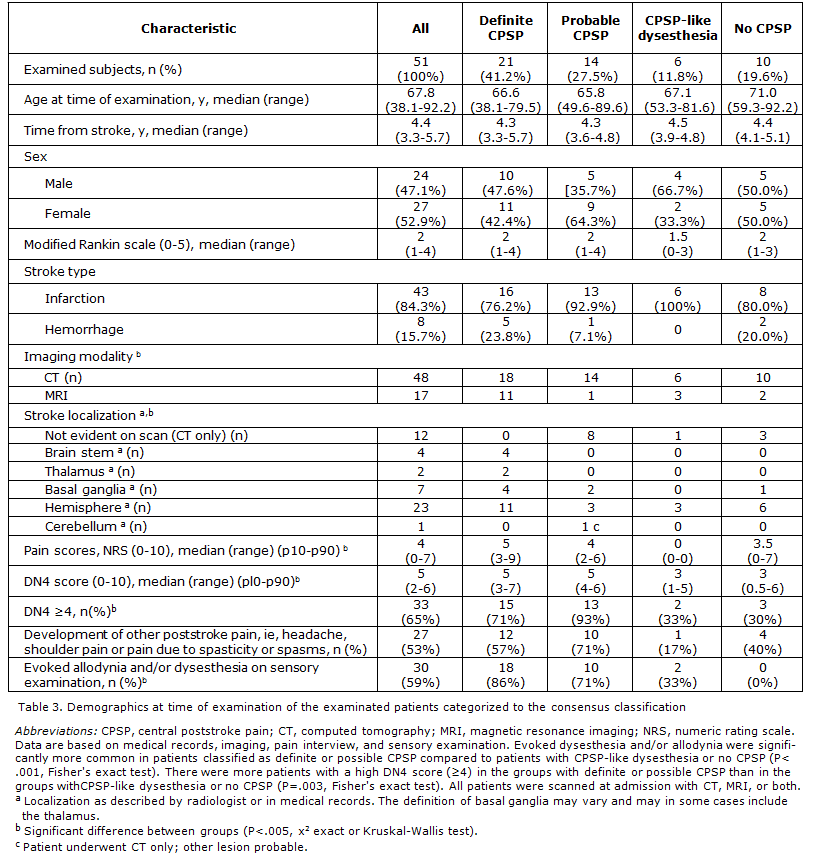
Le caratteristiche del dolore CPSP
Linsorgenza del dolore si manifestava entro tre mesi dallictus nel 60% dei casi, con un andamento giornaliero nel 71%, ed era spesso spontaneo o sia spontaneo che provocato, mentre era meno comune il dolore solo provocato. Lintensità media del dolore nellultima settimana era moderata, 5 nella scala NRS, ma il 66% di questi pazienti avevano uno punteggio di 4 o più nella NRS. In generale il dolore interferiva poco con le attività quotidiane, con lumore, con il sonno, con le attività ricreative, ma vi era una grande variabilità individuale.
Nel 23% dei pazienti il dolore era diminuito sia dintensità sia come distribuzione rispetto allinizio, mentre nel 34% era aumentato. Più comunemente il dolore era descritto come “bruciante e come “freddo doloroso, mentre i disturbi della sensibilità nellarea del dolore erano descritti come “formicolio, “punture di spilli, e “intirizzito, mentre solo 6 pazienti riferivano il prurito. Il 63% dei pazienti con CPSP ha riferito condizioni dolorose concomitanti. Tutti i pazienti con CPSP hanno riferito alterazioni della sensibilità e tutti hanno mostrato una riduzione della sensibilità ai test di stimolazione mentre l 86% dei casi ha mostrato sia un aumento che una diminuzione della sensibilità. Il 66% dei pazienti presentava iperalgesia o allodinia e 80% aveva o allodinia o disestesia evocata con i test della sensibilità. Erano di comune riscontro lallodinia per il freddo (40%), liperalgesia alla puntura di spillo (57%), la disestesia da freddo (66%), da sfioramento (51%) e al tocco.
Non cerano pazienti con test per la sensibilità al freddo e alla puntura nella norma.
Dei trentacinque pazienti con CPSP, ventotto assumeva uno dei seguenti farmaci o regolarmente o al bisogno: Fans, paracetamolo, oppioidi deboli, oppioidi forti, antiepilettici come pregabalin, gabapentin e lamotrigina, antidepressivi triciclici, antidepressivi SSRI o SNRI. Nove pazienti avevano provato e poi abbandonato alcuni dei seguenti farmaci: pregabali, gabapentin, lamotrigina, antidepressivi triciclici, fans, paracetamolo, tramadolo e ossicodone.
Discussione
Questo studio di popolazione sul dolore post ictus ha utilizzato criteri ben definiti e rigorosi, un approccio valido e un esame clinico dettagliato e standardizzato per stimare la prevalenza del dolore post ictus e descriverne le caratteristiche cliniche.
La popolazione è stata selezionata mediante un questionario e quelli che avevano soddisfatto pienamente i quattro criteri di arruolamento previsti dal questionario per un possibile CPSP (11%) sono stati selezionati per un ulteriore esame clinico. Con lesame clinico il 3.6% presentava un CPSP certo, mentre il 5.8% presentava un CPSP certo o probabile e quelli che presentavano un dolore o disestesia tipo CPSP costituivano il 6.7% della popolazione del questionario.
La mancanza di criteri diagnostici “gold standard per il CPSP, così come per altri dolori di natura neuropatica rende difficoltosa la validazione dei risultati dello studio. Gli autori hanno tentato di verificare la diagnosi di CPSP con due metodi diversi: il primo, basato sul “miglior giudizio clinico utilizzando tutte le informazioni disponibili comprese la storia clinica e lanalisi della sensibilità; il secondo si basava sul sistema di classificazione di Treede, denominato “Grading System.
Diversi strumenti di screening sono stati proposti per la diagnosi di dolore neuropatico. In questo studio la specificità è stata 0.8 e la sensibilità 0.68 considerando lesame clinico come gold standard. Il questionario può essere daiuto per la diagnosi, ma poiché i pazienti possono avere un dolore neuropatico non correlato allictus e peraltro possono presentare parestesie e disestesie insieme a un dolore nocicettivo, la diagnosi di dolore neuropatico dovrebbe sempre essere basata sullesame neurologico.
Come in altri studi anche in questo è stato visto che tutti i pazienti hanno dolore e alterazione della sensibilità alla temperatura, supportando la convinzione che per lo sviluppo di un CPSP sia necessaria una lesione del tratto spinotalamico. E importante segnalare che non cè, a priori, la necessità di anomalie della sensibilità alla temperatura o alla puntura di spillo. Questo studio conferma inoltre, che lallodinia e le parestesie sono comuni nei pazienti con CPSP. Questi disturbi assumono il significato dipereccitabilità neuronale del sistema nervoso. Sebbene i meccanismi sottostanti a questa ipereccitabilità siano sconosciuti, si può ipotizzare una disinibizione dovuta a una specifica lesione del sistema nervoso centrale ( vedi Klit et al. ). Lo studio dimostra inoltre che altre condizioni concomitanti al dolore post ictus sono comuni nei pazienti con CPSP (63%). Il dolore cronico è comune nei pazienti che sopravvivono a un ictus rappresentando il 55%, ma non si sa se la frequenza del dolore nocicettivo o di altri tipi di dolore neuropatico sia più alta nei pazienti con CPSP. E possibile che lalto numero sia dovuto alla relativa età avanzata dei soggetti, alla frequenza di comorbidità e di farmaci assunti o ad altri tipi di dolore che possono essere conseguenza dellictus come il dolore da contratture o il dolore di spalla. La diagnosi di CPSP è quindi complicata dal fatto che in alcuni pazienti, classificati come CPSP possibile, non si potevano escludere con certezza altre cause di dolore. In questo studio i pazienti riferivano spesso un dolore dintensità moderata e che interferiva poco con le attività quotidiane, con il sonno, con lumore e con le attività ricreative. In studi precedenti i pazienti avevano riportato un dolore da moderato a severo e molto disturbante. Alcuni di questi studi erano condotti su casi più severi in quanto includevano pazienti seguiti in reparti di neurologia o in cliniche del dolore. In questo studio almeno un quarto di pazienti riferiva un aumento del dolore nel tempo, mentre in cinque pazienti con CPSP sospetto, il dolore e la disestesia si erano risolti entro quattro anni dallictus. Alcuni pazienti attribuivano questa riduzione del dolore alla loro capacità di gestirlo, ma può essere probabile che il CPSP sia una condizione in cui i sintomi fluttuano o cambiano nel tempo. Sarebbero necessari quindi successivi studi prospettici per valutare la storia naturale del CPSP.
In conclusione, la prevalenza stimata nello studio del CPSP certo o probabile è del 7,3%. Se si comprende anche la disestesia, la prevalenza è del 8.6%. Tutti i pazienti con CPSP hanno una riduzione della sensibilità ad almeno un test di valutazione, e spesso hanno unaumentata sensibilità al dolore evocato con il freddo o con il tocco e una disestesia o uniperalgesia alla puntura di spillo.
Rilevanza per la medicina generale e commento del revisore
Il dolore centrale post ictus è una specifica condizione che insorge come diretta conseguenza di una lesione cerebrovascolare. Vi sono limitate conoscenze sullepidemiologia e sulle caratteristiche cliniche di questa misconosciuta ma grave, conseguenza dellictus.
Peraltro la concomitante presenza di altre condizioni dolorose sostenute da altre cause, rende ancora più difficoltosa la diagnosi e conseguentemente una terapia appropriata. Il dolore neuropatico, è risaputo, risponde poco ai comuni analgesici, come FANS, paracetamolo, oppioidi deboli, mentre rilevanti risultati si ottengono con farmaci specifici come gli antiepilettici. E quindi di fondamentale importanza sospettare la presenza di questa condizione nei pazienti con ictus e sottoporli a un accurato esame della sensibilità che è di pertinenza degli esperti di terapia del dolore, stante le notevoli difficoltà diagnostiche che il CPSP presenta e che lo studio evidenzia.
La mancanza di una procedura “gold standard, rende la diagnosi molto problematica anche per gli esperti, ma questo non esime il MMG dal conoscere ed eventualmente sospettare questa grave patologia nei pazienti con ictus già gravati da altri gravi deficit derivanti dalla loro malattia.



