Area Osteo-Mioarticolare [Numero 6. Ottobre 2012] Fratture in clinica, al di là dei bassi valori di densità ossea |  |
Sintesi
Il rischio di fratture è multifattoriale ed è relativo alla capacità dellosso di resistere alla frattura, che dipende dai suoi costituenti e dalle sue proprietà strutturali, e da intensità, frequenza e impatto del trauma. Bassi valori di densità ossea (BMD) sono un elemento determinante della resistenza ossea e del rischio di fratture. Tuttavia, la maggior parte dei pazienti con una frattura non hanno l’osteoporosi e BMD spiega <50% dei problemi di resistenza ossea e di rischio di fratture. Al di là del BMD, la resistenza delle ossa può essere calcolata con l’analisi delle immagini strutturali 2D e 3D , ma questo non fa ancora parte della pratica clinica quotidiana. Il rischio di frattura può essere valutata integrando BMD con la valutazione sistematica dei fattori di rischio clinici, come nello strumento di valutazione del rischio di frattura (FRAX) algoritmo di ricerca dei casi (età, storia personale e familiare di fratture cliniche, stile di vita, malattie e farmaci). Fattori di rischio clinici, non inclusi in FRAX sono rischi di caduta, il numero e i tempi delle precedenti fratture cliniche, la presenza, il numero e la gravità delle fratture vertebrali morfometriche e la dose di glucocorticoidi. Questi sono stati inclusi in altri strumenti per la ricerca di casi, come ad esempio il Calcolatore Garvan di Rischio di Frattura, il Rischio di Frattura in Utilizzatori di Glucocorticosteroidi e il Nomogramma Maastricht di Rischio di Frattura. Sono richiesti ulteriori affinamenti degli algoritmi di ricerca dei casi, per integrare BMD, i calcoli sulla resistenza ossea e i fattori di rischio clinici o avere un unico algoritmo per la predizione del rischio di frattura, che potranno essere utilizzati nella pratica quotidiana.
Introduzione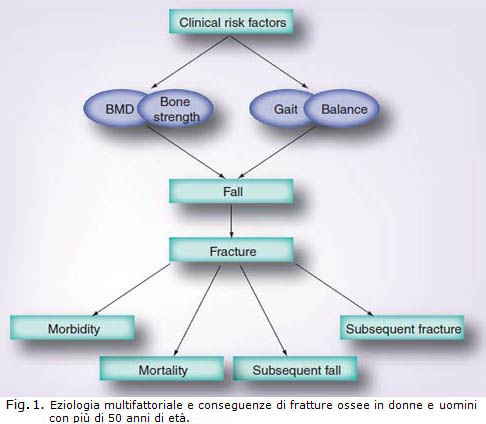
Il rischio di frattura nel corso della vita per una donna bianca di 50 anni di età è > 50%, negli uomini invece è > 20%, comunque è un valore che varia tra le popolazioni. L’incidenza della maggior parte delle fratture aumenta esponenzialmente con l’avanzare dell’età. Le fratture hanno costi importanti e causano una notevole disabilità e morbilità, a seconda della posizione della frattura, delletà e del sesso. Dopo una frattura, il rischio di mortalità, morbilità e conseguente frattura è aumentato ed è più alto nei primi anni dopo la prima frattura. La resistenza dell’osso alle fratture è determinata da BMD e da molti altri componenti. Questi includono macroarchitetture ossee (geometria), microarchitetture (numero trabecolare, spessore e connettività), porosità corticale, proprietà della matrice (cross-linking del collagene e proteine diverse dal collagene), densità di mineralizzazione dei tessuti, caratteristiche del cristallo, accumulo dei danni (lavvio della frattura e la tenacia della riparazione della frattura) e riparazione della frattura. L’eziologia delle fratture è quindi multifattoriale (fig 1). In questo articolo, abbiamo esaminato le caratteristiche strutturali del tessuto osseo che contribuiscono alla resistenza ossea e i fattori di rischio clinici che contribuiscono al rischio di frattura, indipendentemente da BMD.
BMD e rischio di frattura
Attualmente, la diagnosi di osteoporosi si basa sulla misura di BMD areale (aBMD) con assorbimetria a raggi X a doppia energia (DXA). DXA è una tecnica di imaging di progettazione che misura l’assorbimento relativo di un tessuto di uno spettro raggi X a doppia energia e fornisce la densità di area come g/cm2. Dalla sua introduzione nel 1987, DXA è diventato il mezzo più ampiamente accettato di misura di BMD. Molti studi hanno dimostrato che una diminuzione di aBMD sia un fattore di rischio di fratture. I più alti tassi di frattura sono stati osservati tra le donne con osteoporosi (definito sulla base di solo aBMD). In una grande meta-analisi di studi prospettici di coorte di donne (età media 53-73 anni, periodo medio di follow-up di 0.7-26 anni), il rischio relativo di fratture di avambraccio, anca, vertebre e in generale di tutte, aumenta 1,6-2,5 volte per ogni riduzione della deviazione standard (SD) di aBMD. Misure sito-specifiche di aBMD a livello della colonna lombare e dell’anca sono meglio predittivi di fratture in tali siti, rispetto a misurazioni in altri distretti ossei. Lassorbimetria a raggi X a doppia energia è ormai considerata lo standard per misurare la componente aBMD del rischio di frattura nella pratica quotidiana. La misurazione di BMD ha contribuito allepidemiologia, alla fisiopatologia, alla rilevazione e al trattamento di pazienti ad alto rischio di fratture. Tuttavia, l’interpretazione di BMD ha diversi limiti. In primo luogo, anche se il rischio di frattura è massimo in pazienti con bassi valori di aBMD (cioè, con osteoporosi), la maggior parte dei pazienti con una frattura ossea non soffrono di osteoporosi al momento della frattura. In una vasta indagine su donne in postmenopausa, l’82% delle pazienti con fratture ha presentato valori di T-scores maggiori di -2,5 DS rispetto al riferimento, utilizzando dispositivi di misura periferici (nell’avambraccio tallone, o dito). In pazienti con una recente frattura dell’anca, che è considerata la maggiore frattura osteoporotica, solo il 41% presentava un T-score<-2,5 aBMD per la testa del femore. In pazienti con fratture frequenti, che rappresentano il 25-40% di tutte le fratture dopo l’età di 50 anni, solo il 33% degli uomini e il 50% delle donne ha presentato osteoporosi. In pazienti con una recente frattura non vertebrale, il 25% aveva anche una frattura vertebrale, oltre la metà delle quali sono state trovate in pazienti senza osteoporosi aBMD. In pazienti con una recente frattura clinica, il 27% presentava recentemente una diagnosi di osteoporosi secondaria e malattie metaboliche dell’osso, di cui il 57% degli uomini e il 49% delle donne non presentavano osteoporosi. In secondo luogo, meno del 60% della variazione nella resistenza dellintero osso femorale è attribuibile alle variazioni di BMD. Le variazioni di BMD durante il trattamento con farmaci anti-riassorbimento osseo sono legati alla riduzione del rischio di fratture, ma laumento di BMD non riesce da solo a spiegare tale effetto, tranne il ranelato di stronzio. In terzo luogo, le misure 2D possono, tanto per le ossa grandi che per le piccole, presentare una maggiore aBMD a causa delle differenze di profondità ossea. L’osso con BMD inferiore può aver acquisito meno, o perso più, osso. Inoltre, anche DXA non distingue l’osso corticale dallo spongioso, né variazioni di aBMD forniscono informazioni riguardanti la base morfologica di tale cambiamento. In quarto luogo, la relazione tra BMD e rischio di fratture è fortemente dipendente da fattori di rischio clinici. Ad esempio, il rischio a 5 anni di frattura dell’anca è < 5% con qualsiasi BMD per età inferiore ai 65 anni, ma nelle donne di età superiore a 65 anni, varia tra < 5% al collo femorale (FN) con T-score > - 2,0-20% e T-score FN di -3,5. Relazioni simili sono state trovate considerando rischio di frattura vertebrale a 5 anni, età e BMD. La relazione tra il rischio a 5 anni di fratture non vertebrali lombari da trauma e BMD aumenta con l’età, ma non come per le fratture dell’anca e vertebrali. Tali limitazioni di BMD hanno generato una vasta ricerca in metodi per calcolare la resistenza ossea e predire il rischio di frattura.
Misure alternative della resistenza ossea
Dato le limitazioni della misurazione di BMD, sono stati sviluppati metodi analitici per valutare le componenti biomeccaniche dell osso, basate su caratteristiche strutturali dell’osso. Sono state eseguite analisi della struttura ossea per calcolarne la resistenza con tecniche 2D di progettazione, incluso DXA, radiografia standard o ad alta risoluzione digitale (HRDR), e metodi di imaging 3D, come la tomografia computerizzata quantitativa (QCT), la risonanza magnetica MRI e tecniche ad ultrasuoni quantitative (Tab. 1). 
La macroarchitettura è stata valutata misurando la lunghezza dell’asse dell’anca (HAL), la lunghezza dell’asse del collo femorale (FNAL), langolo collo/albero del femore (FSA), il momento dinerzia sezione trasversale (CSMI), il momento di inerzia (MI), limmagine laterale su immagini 2D di radiografie digitalizzate e DXA, e imaging 3D con CT e MRI. La microarchitettura può essere valutata con le radiografie 2D, che permettono di applicare tecniche di analisi tissutale per valutare larchitettura trabecolare. La microarchitettura corticale e trabecolare volumetrica 3D può essere valutata mediante CT e MRI, e permette di studiare le porzioni corticale e trabecolare separatamente. L’analisi strutturale è ancora in fase sperimentale e non è ancora utilizzata di routine nella pratica quotidiana.
Analisi strutturale di immagini radiografiche 2D
Densitometria ossea. I recenti progressi in DXA includono un software che calcola automaticamente alcuni parametri strutturali del femore prossimale strutturali (HAL), larea della sezione trasversale del collo femorale (CSA), MI, e FSA. HAL è la distanza lungo l’asse del collo femorale dalla base del grande trocantere fino all’orlo pelvico. CSMI è una misura di come la matrice ossea è distribuita nel collo del femore. Questi parametri strutturali, che si confrontano ragionevolmente con misure simili ottenute con QCT volumetrica, possono essere combinati con l’altezza del soggetto, il peso e letà per il calcolo dell’indice di resistenza femorale (FSI). In uno studio di confronto tra pazienti con frattura dellanca e soggetti controllo di età superiore a 50 anni, la previsione di frattura è stata marginalmente migliorata combinando T-score con HAL e FSI rispetto a T-score valutato da solo. CSMI del collo del femore, CSA e FSA non sono risultati essere predittori indipendenti di fratture dell’anca. Questi risultati sono in linea con i dati provenienti da Wang et al. che hanno dimostrato che non vi era alcuna differenza tra aBMD, HAL o FSA tra i pazienti con fratture dell’anca e controlli. Recentemente, è stato riferito che lassorbimetria a raggi X a doppia energia volumetrica (VXA), che utilizza un sistema DXA per ricostruire il femore prossimale da quattro scansioni DXA, forniva buone correlazioni con QCT in materia di HAL e CSA. Forse questa nuova tecnica può contribuire a migliorare la previsione di fratture dell’anca con DXA. Inoltre, la valutazione di fratture vertebrali con DXA fornisce un’immagine della colonna toracica e lombare allo scopo di rilevare deformità da fratture vertebrali. Il riconoscimento di una frattura vertebrale precedentemente non rilevata contribuisce alla valutazione del rischio di frattura, e alle scelte di trattamento.
Radiografia standard. Le radiografie standard sono utilizzate per diagnosticare le fratture. La presenza di un piccolo trauma vertebrale o di una frattura non vertebrale è prova di una resistenza ossea ridotta, indipendentemente da BMD. Il rischio di fratture successive è legato al numero di fratture precedenti e alla presenza, gravità e numero di fratture vertebrali. Mentre la maggior parte delle fratture non vertebrali sono facili da diagnosticare, in due su tre fratture vertebrali non sono presenti i segni e i sintomi clinici di una frattura, e spesso non vengono diagnosticate finché viene eseguita limaging della colonna vertebrale, ma vengono spesso trascurate o non individuate quando le radiografie della colonna vertebrale sono disponibili. Limaging della colonna vertebrale permette di valutare le altezze vertebrali con SQ, per il quale si utilizza spesso il punteggio Genant. Lispezione visiva delle radiografie non è sufficiente per quantificare la perdita ossea. Si stima che una perdita ossea inferiore al 20-40% non può essere rilevata con le radiografie standard. Le radiografie standard sono state utilizzate anche per valutare l’architettura del tessuto trabecolare. Lanalisi frattale dellosso trasecolare, che riflette lanisotropia, ha buone correlazioni con la tomografia 3D microcomputerizzata. In pazienti con una storia di fratture, lanalisi tissutale radiografica (RTA) ha fornito una stima della fragilità ossea indipendente e complementare alla misura BMD e all’età. La modellazione attiva della forma (ASM) è un metodo che, usando le radiografie digitalizzate dell’anca, integra le misurazioni della forma del femore prossimale con lampiezza del collo del femore e la lunghezza del collo femorale. La precisione di discriminazione tra pazienti con e senza una frattura dell’anca è stata migliorata combinando modalità ASM con BMD del collo del femore o intertrocanterica.
Imaging 3D
Tomografia Computerizzata Quantitativa (QCT). Le misurazioni della tomografia computerizzata quantitativa sono segnalate come densità volumetriche vere (mg/cm3). QCT volumetrico può analizzare sia la densitometria che le componenti geometriche dellintero osso o delle sue componenti corticale e trabecolare separatamente, non è limitata dai limiti inerenti alla radiografia di progettazione e agli esami DXA (Figura 2).  Il test biomeccanico dellanca di cadavere ha dimostrato che la resistenza è legata allosso trabecolare e corticale, e che la previsione della resistenza può essere migliorata combinando BMD con le caratteristiche geometriche, tra cui CSA, FNAL usando QCT.
Il test biomeccanico dellanca di cadavere ha dimostrato che la resistenza è legata allosso trabecolare e corticale, e che la previsione della resistenza può essere migliorata combinando BMD con le caratteristiche geometriche, tra cui CSA, FNAL usando QCT.
QCT Volumetrico e la MRI consentono la valutazione in vivo delle differenze subregionali nella struttura trabecolare e nella densità. Il metodo progettuale di modellazione fondato sullanalisi degli elementi finiti (FEA) può essere utilizzato per migliorare la stima con QCT della resistenza ossea. I dati da QCT sono convertiti in modelli ‘voxel’ di elementi finiti per ottenere misure di resistenza ossea. Modelli di elementi finiti altamente automatizzati sono stati superiori a metodi basati sulla correlazione con QCT nel predire la resistenza vertebrale alla compressione. Lanalisi di elementi finiti offre anche la possibilità di prevedere direttamente l’effetto di diversi trattamenti per l’osteoporosi sulla resistenza ossea. E ‘stato dimostrato che sia la teriparatide che l’alendronato su un periodo di 18 mesi miglioravano la resistenza vertebrale aumentando la densità volumetrica, ma l’effetto sulla resistenza vertebrale era più pronunciato con teriparatide, che preferenzialmente migliora la densità e la resistenza della componente trabecolare. Questo effetto aumentato di teriparatide è stato evidente solo con la modellazione di elementi finiti e non con la misurazione DXA di BMD. In un recente studio, FEA ha dimostrato che il trattamento con Teriparatide porta ad un aumento della resistenza ossea vertebrale fino al 30% durante la compressione e la flessione. Partendo dalle implicazioni teoriche di un trial clinico di 2 anni in donne in postmenopausa trattate con alendronato, un ormone paratiroideo o sue combinazioni, il calcolo della soglia di frattura biomeccanica può portare a nuove intuizioni e progressi nella valutazione e nel trattamento dell’osteoporosi e nella riduzione del rischio di frattura. Con la recente introduzione di una nuova generazione di un sistema QCT ad alta risoluzione 3D periferico, la quantificazione diretta dei parametri ossei strutturali è diventata fattibile con una risoluzione di 80 micron (Figura 2). Essa consente misurazioni del radio distale e della tibia in vivo con una radiazione bassa (3 Sievert), ed è una tecnica promettente per la valutazione dei cambiamenti trabecolari, nella dimensione corticale e nella porosità. In uno studio caso-controllo che ha coinvolto 101 donne con fratture prevalentemente da fragilità e 101 controlli di pari età, dalla coorte OFELY, è stato recentemente dimostrato che i parametri FEA del radio e della tibia ottenuti con un sistema QCT ad alta risoluzione 3D periferico erano associati con tutti i tipi di fratture da fragilità ossea.
MRI . Presenta vantaggi nel valutare la qualità dell’osso rispetto a CT, quali la mancanza di radiazioni ionizzanti e la capacità di valutare gli aspetti fisiologici oltre alla struttura ossea, come i costituenti, la diffusione e la perfusione del midollo. I suoi svantaggi noti includono il costo e la complessità delle apparecchiature MRI e lanalisi. MRI in vivo dellarchitettura trabecolare è di solito eseguita al radio distale o al calcagno, in quanto queste aree sono accessibili alle piccole bobine ad alta risoluzione. Quasi tutti i parametri strutturali derivati della risonanza magnetica MRI del radio distale sono migliori di DXA per differenziare tra donne con e senza fratture vertebrali. MRI ad alta risoluzione dello scheletro osseo centrale è limitata da problemi di risoluzione. La risoluzione delle immagini MRI limita l’applicazione di analisi strutturali 3D dell’anca. Il potenziale di MRI, come mezzo di imaging della struttura del femore prossimale, richiede miglioramenti nella tecnica e miglioramenti della risoluzione.
Ecografia quantitativa. È un altro metodo per misurare le caratteristiche di resistenza e di densità ossea. Diversi grandi studi prospettici hanno dimostrato che lecografia quantitativa del calcagno può predire il rischio di future fratture quasi come DXA. Inoltre, a differenza di DXA, essa può valutare la qualità dell’osso, oltre a BMD.
Fattori di rischio clinici per le fratture
Strumenti di valutazione del rischio di frattura
Lalgoritmo di ricerca del caso per la valutazione del rischio di frattura (FRAX) è stato sviluppato per predire il rischio a 10 anni delle principali fratture osteoporotiche (ad esempio, clinica vertebrale, del polso e dell’omero) e di fratture dell’anca. È basato su una valutazione sistematica dei principali fattori di rischio clinici (ad esempio, età, storia personale e familiare di fratture cliniche, stile di vita, malattie e farmaci). Può essere calcolato con o senza BMD (Box 1). Con FRAX, le scelte diagnostiche e terapeutiche possono essere basate su soglie di rischio assoluto di frattura, che sono disponibili nelle linee guida per losteoporosi recentemente aggiornate del Regno Unito e degli USA. Tuttavia, FRAX ha diversi limiti. FRAX non comprende i rischi di caduta, il raggruppamento di fratture nel tempo (cioè, il rischio di fratture successive è più alto nei primi anni dopo una frattura) e il valore di alcuni fattori di rischio, come ad esempio la dose giornaliera e cumulativa di glucocorticoidi o il peso di una frattura precedente in termini di numero e gravità delle precedenti fratture vertebrali e non vertebrali. Perciò, FRAX può sottovalutare il rischio di fratture nei soggetti con elevato rischio di esposizione aggiuntivo, come una frattura recente, cadute recenti e alte dosi di glucocorticoidi.
Il calcolatore di rischio di frattura Garvan
Ogni anno, circa un terzo della popolazione mondiale di età superiore a 65 anni e quasi la metà delle persone istituzionalizzate o di persone di età superiore ai 80 anni va incontro a una caduta. La metà di loro sperimenterà un’altra caduta entro l anno successivo. Circa il 10-15% delle cadute finisce in una frattura, e questa è ancora più elevata tra i residenti delle case di riposo. L’associazione tra i rischi di caduta e il rischio di frattura è stato ampiamente documentato, indipendentemente da altri fattori di rischio per le fratture e da BMD . Tali rischi di caduta includono rallentata velocità di cammino, camminare a braccetto e visione diminuita, instabilità posturale e/o debolezza del quadricipite e storia di cadute, stato di salute auto-riferito, stato di attività fisica auto-riferito, disturbi cognitivi, morbo di Parkinson, uso di psicofarmaci con effetti sul SNC e politerapie. Il calcolatore Garvan di rischio di frattura (GFRC) è un altro strumento, disponibile online per calcolare il rischio di frattura osteoporotica e dell’anca. GFRC differisce da FRAX perché tiene conto della storia di cadute recenti (1, 2 e > 2 cadute recenti) e del numero di fratture precedenti (1, 2 e > 2), ma non include altri rischi compresi in FRAX. Inoltre prevede più tipi di fratture rispetto a FRAX. Come risultato, i calcoli a 10 anni del rischio di fratture differiscono tra i due algoritmi. Rispetto a GFRC, FRAX sottostima il rischio di frattura in pazienti con due o più fratture e con uno o più cadute recenti. D’altra parte, GFRC sottostima il rischio di fratture nelle donne con una storia familiare di frattura dell’anca e nelle donne con osteoporosi secondaria, rispetto a FRAX. Nonostante queste differenze, entrambi gli approcci sono ragionevolmente accurati nelle donne.
Altri strumenti di valutazione del rischio di frattura
Il calcolatore MaasFran Fracture Risk comprende il tempo trascorso dalla frattura precedente, il che aumenta il rischio di fratture successive a breve termine. In pazienti con frattura recente, il rischio calcolato a 10 anni di fratture è più alto quando si utilizza MaasFran anziché FRAX. È possibile calcolare il rischio di fratture con MaasFran utilizzando un nomogramma. Il calcolatore del fattore di rischio di fratture con luso di glucocorticoidi (FIGS) comprende la dose giornaliera e cumulativa di glucocorticoidi come fattore di rischio. In pazienti trattati con alte dosi di glucocorticoidi, il calcolo a 10 anni del rischio di frattura è più elevato quando si usa FIGS. Tuttavia, nella pratica quotidiana non si usa alcun calcolatore FIGS. Soprattutto, questi strumenti hanno bisogno di una validazione prospettica in altre popolazioni.
Prospettive future
L’eziologia delle fratture è multifattoriale. BMD bassa, parametri di resistenza delle ossa, fattori di rischio collegati alla caduta, tutti contribuiscono al rischio di frattura (Figura 1). Pertanto, la previsione del rischio di frattura può essere migliorata combinando questi predittori, ed è possibile nella pratica quotidiana mediante la valutazione della presenza di fattori di rischio clinici, misurando BMD e valutando il rischio di cadute. È attraente calcolare il rischio assoluto di frattura, integrando rischi clinici, BMD, la geometria delle ossa e i rischi legati alla caduta, ma ciò richiede un ulteriore affinamento integrando questi fattori di rischio in un unico algoritmo per uso clinico. La valutazione dei fattori di rischio non è solo utile per individuare i soggetti a più alto rischio di fratture, ma servirà anche per decidere, in condivisione con il paziente, se iniziare o meno una terapia farmacologica. La prossima sfida sarà quella di determinare a quale livello di rischio di frattura, il trattamento deve essere iniziato. E ‘stato dimostrato in studi randomizzati e controllati che in pazienti, selezionati sulla base di un basso BMD o di una prevalente frattura vertebrale o dellanca, è possibile prevenire altre fratture ossee. Saranno necessari studi per valutare se il trattamento è efficace anche quando la selezione del paziente è basata sulla presenza di altri fattori di rischio, incluse le caratteristiche strutturali del tessuto ossee.
Punti essenziali
-
Il rischio di fratture è multifattoriale e dipende dalle proprietà materiali e strutturali delle ossa e sulla frequenza, intensità e impatto del trauma.
-
Basso BMD è un elemento determinante della resistenza ossea e del rischio di fratture, ma la maggior parte dei pazienti con una frattura non presenta osteoporosi.
-
BMD spiega per <50% la resistenza ossea e il rischio di fratture.
-
La resistenza ossea può essere calcolata mediante l’analisi delle immagini strutturali 2D e 3D delle ossa, ma questo non è ancora parte della pratica clinica quotidiana.
-
Il rischio di frattura può essere valutato integrando BMD con la valutazione sistematica dei fattori di rischio clinici, come ad esempio lalgoritmo di ricerca del caso strumento per la valutazione del rischio di frattura.Le cadute precedenti sono incluse nel calcolatore Garvan del rischio di frattura.
-
La dose di glucocorticoidi è inclusa nel rischio di fratture negli utilizzatori di glucocorticosteroidi.Il tempo trascorso dallultima frattura ossea è incluso nel Nomogramma Maastricht del rischio di frattura.
-
È necessario un affinamento ulteriore degli algoritmi di ricerca del caso ed integrare BMD, calcoli di resistenza ossea e fattori di rischio clinici in un unico algoritmo per la predizione del rischio di frattura, che può essere utilizzato nella pratica quotidiana.
Rilevanza per la medicina di famiglia e commento del revisore
Il MG deve prendere delle decisioni su quando iniziare un trattamento per losteoporosi, e per quanto tempo. La sola valutazione della densitometria (rilevazione del BMD = densità minerale ossea) non è sufficiente perché solo nel 50% dei fratturati esiste un basso BMD. Il calcolo del rischio di frattura attraverso indagini strumentali e di laboratorio od attraverso algoritmi, è perfettibile. Esistono diverse tecniche strumentali che dovrebbero analizzare le componenti biomeccaniche dellosso, ma ancora non esiste un esame strumentale, da utilizzare nella pratica quotidiana, che permetta lanalisi strutturale dellosso. Esistono poi diversi algoritmi che valutano e predicono il rischio di frattura: il FRAX è basato sui principali fattori di rischio (età, storia personale e familiare di fratture cliniche, stile di vita, malattie e farmaci), mentre il calcolatore GARVAN (GRFC) pone più attenzione al rischio di caduta, tenendo conto della storia di cadute recenti (1, 2 e > 2 cadute recenti) e del numero di fratture precedenti (1, 2 e > 2), ma non include altri rischi compresi in FRAX. Il nomogramma MAASFRAN FRACTURE RISK comprende il tempo trascorso dalla frattura precedente, ed in pazienti con frattura recente il rischio calcolato con questo algoritmo è più alto rispetto al FRAX. Il FIGS è Il calcolatore per chi utilizza glucocorticoidi e comprende la dose giornaliera e cumulativa di glucocorticoidi come fattore di rischio. I risultati dei diversi algoritmi non collimano e necessitano di una validazione prospettica sulle diverse popolazioni: è quindi necessario, per un utilizzo nella pratica quotidiana, un affinamento ulteriore degli algoritmi al fine di integrare BMD, calcoli di resistenza ossea e fattori di rischio clinici in un unico algoritmo per la predizione del rischio di frattura.



