Terapia del Dolore [TERAPIA DEL DOLORE] Le sindromi algiche conseguenti a complicazioni della malattia diabetica |  |
Introduzione
I medici, non solo i medici di medicina generale, nell’approccio al paziente con dolore, al fine di impostare una terapia farmacologica sono spesso guidati da due criteri: la correlazione della sindrome algica con la malattia possibile causa del dolore stesso e l’intensità del dolore. L’equazione che immediatamente scatta nella mente dei medici è che a una certa patologia correli un tipo di dolore. Così la presenza nella patologia del suffisso –ite (es. sacroileite, spondilite, periartrite, ecc.) connota un dolore la cui causa è di norma infiammatoria, mentre una malattia facilmente identificabile come l’herpes zoster connota un dolore di tipo neuropatico, ecc.
In buona sostanza la diagnosi della malattia che causa presumibilmente il dolore fornisce la chiave interpretativa della natura del dolore e quindi anche della terapia farmacologica appropriata. Questo modo di procedere non è ovviamente privo di razionale scientifico, tuttavia può esporre il medico a grossolani errori.
Il paziente da molti anni diabetico, con valori di emoglobina glicata al di sopra della norma da molto tempo, che descrive il suo dolore agli arti inferiori con una ricca semantica (distribuzione a calza, bruciore, spilli, ecc.) giustamente fa scattare nel medico il sospetto di polineuropatia diabetica. Il passo successivo è spesso il ricorso alla prescrizione di un esame elettromiografico, per confermare il sospetto, iniziando nel contempo una terapia di attesa con uno dei farmaci indicati per il dolore neuropatico (es. alfa2deltaligandi, duloxetina). Per contro, l’eventuale risultato negativo della elettromiografia, farà riconsiderare allo stesso medico il suo sospetto diagnostico e sospenderà il farmaco precedentemente impostato avviando altre indagini alla ricerca della causa del dolore, ritenuta fondamentale per prescrivere una terapia antalgica.
In questo articolo si desidera in parte confutare questo approccio, riconsiderando nel suo significato predittivo l’anamnesi (oggi ritenuta meno significativa di un tempo al fine della diagnosi del tipo di dolore) e introducendo un approccio semeiologico molto spesso “trascurato” dai medici (di Medicina Generale e non).
L’esame obiettivo correttamente condotto permette di avvalorare l’ipotesi di dolore neuropatico oppure confermare l’origine del dolore dai nocicettori periferici e in entrambi i casi confermare o meno la presenza di segni clinici rilevabili di coinvolgimento dei neuroni spinali (presenza di ipersensibilità spinale, da taluni chiamata “componente neuropatica”).
Senza distogliere il medico dal ricercare attivamente la causa del dolore (che può consentire una terapia etiologica del dolore) si vuole porre l’accento sulla necessità di procedere a un esame obiettivo che confermi l’origine del dolore, che resta nell’immediato il criterio fondamentale per impostare da subito una appropriata terapia antalgica. La diagnosi algologica ricerca quindi il “pain generator”, ovvero il sito da cui origina il dolore (nocicettore periferico, fibra nervosa) e ricerca nel contempo i segni di ipersensibilità spinale.
Definire la diagnosi algologica ha il grande vantaggio che essa, indipendentemente dai risultati degli accertamenti correttamente richiesti, permette di impostare da subito una razionale e appropriata terapia farmacologica per il controllo del dolore e una sua descrizione dettagliata la si può trovare nel volume recentemente edito dal Ministero della Salute per i medici di famiglia 1.
Il trattamento del dolore nel paziente con diabete mellito costituisce una sfida ai luoghi comuni e ai comportamenti stereotipati del medico.
Le sindromi algiche conseguenti a complicazioni della malattia diabetica
La polineuropatia diabetica e la polineuropatia diabetica dolorosa
La neuropatia diabetica è una complicanza comune del diabete, con prevalenze comprese fra 13 e 32% 2 a seconda delle popolazioni diabetiche studiate (le percentuali più alte derivano anche da uno studio multicentrico italiano su una casistica di 8.747 pazienti) 3. È una condizione progressiva che interessa gradualmente le fibre sensitive piccole e grandi determinando deficit sensitivi e dolore di tipo neuropatico con distribuzione “a guanto” e a “calza”. Si ritiene che la causa primaria della neuropatia diabetica sia l’iperglicemia ed è stata dimostrata l’efficacia di un controllo rigoroso dei valori glicemici nel ritardare la comparsa e rallentare la progressione della neuropatia.
Non vi sono molti dati in letteratura invece sulla polineuropatia diabetica dolorosa (PNDD).
Alcuni autori hanno trovato che il dolore neuropatico nei pazienti diabetici è presente nel 7-14% 4, con prevalenze anche maggiori dopo 10 anni di malattia. Uno studio di comparazione tra popolazione diabetica e non ha rilevato che la prevalenza della PNDD era del 16,2%: di questi il 12,5% non aveva mai riferito i sintomi al medico curante e il 39,3% non aveva mai ricevuto trattamenti per il dolore 5.
Ciò che importa rilevare comunque è che la polineuropatia diabetica non dolorosa può essere diagnosticata in anticipo (stadio preclinico) eseguendo i test specifici per rilevare l’alterazione della sensibilità del sistema somato-sensoriale e l’unico provvedimento efficace è il rigoroso controllo del profilo glicemico. Peraltro, proprio perché spesso asintomatica, la polineuropatia diabetica conduce a drammatiche conseguenze (amputazione). La polineuropatia diabetica dolorosa invece, dal momento che si manifesta (presenza del sintomo dolore) e viene confermata dai test che dimostrano la presenza di lesione delle fibre di conduzione (mieliniche-A-beta e A-delta, amieliniche C) assume la connotazione di una vera e propria malattia a sé stante, che necessita di farmaci specifici e di specifico follow-up, indipendentemente dal PDT della malattia di base.
La diagnosi algologica si basa sull’identificazione del pain generator: si eseguono tre semplici test di stimolazione all’interno di un’area che il paziente riferisce dolorosa. Ciascun test verifica l’integrità delle fibre A-beta (tocco con garza), A-delta (punta di graffetta) e delle fibre C (provetta di acqua calda) 6. L’integrità del sistema somato-sensoriale esclude che il dolore sia neuropatico, ovvero che il dolore raccontato dal paziente origini dalle fibre nervose, mentre suggerisce che il dolore origini dai nocicettori.
È osservazione comune che spesso il medico di medicina generale è più attento alla polineuropatia delle grosse fibre mieliniche (A-beta e A-delta) poiché in tutti i PDT diabete vi è la raccomandazione di utilizzare diapason e filamenti di Von Frey e l’esame frequentemente prescritto è l’elettromiografia. Del tutto trascurata è la polineuroaptia a “piccole fibre mieliniche C” la cui compromissione peraltro è la causa più frequente del dolore urente. La seconda parte dell’esame obiettivo è fondamentale per valutare se è presente o meno una componente di ipersensibilità spinale: la conferma avviene somministrando stimoli “allodinici”, ovvero stimoli che in altre parti del corpo non risultano dolorosi, mentre invece lo sono nell’area del dolore raccontato dal paziente.
Solo se verrà rilevato deficit di una delle tre fibre del sistema somato-sensoriale sarà confermata la diagnosi di polineuropatia diabetica dolorosa, per contro l’integrità del sistema segnala che il dolore è di origine recettoriale (nocicettivo) e dovrà orientare la diagnosi verso altre possibili cause di dolore.
Da rimarcare che la presenza di ipersensibilità spinale può coesistere sia con il dolore neuropatico, sia con il dolore nocicettivo e richiede l’utilizzo di farmaci specifici. In buona sostanza nel caso di polineuropatia diabetica dolorosa il trattamento farmacologico dovrà prevedere farmaci che agiscono “in primis” sulla fibra e/o fibre nervose lesionate (inibitori dei canali del sodio come amitriptilina, carbamazepina, oxacarbazepina).
Se sono presenti segni di ipersensibilità spinale il trattamento farmacologico dovrà prevedere farmaci ad azione sinaptica (inibitori dei canali del calcio come gli alfa2delta-ligandi gabapentin e pregabalin, antidepressivi triciclici, duloxetina, venlafaxina, baclofene per citare quelli più in uso).
L’utilizzo di oppiacei (2° e 3° gradino OMS) è razionale, essi agiscono a livello sinaptico modulando gli impulsi dolorosi in arrivo e debbono essere presi in considerazione sia per dolori di elevata intensità, sia nei casi in cui non è possibile un trattamento con farmaci di scelta. L’European Federation of Neurological Societies Task Force ha aggiornato recentemente le linee guida per il trattamento del dolore neuropatico 7. La maggior parte dei RCT presi in considerazione includono polineuropatie diabetiche dolorose. Gli autori affermano non esserci differenze di approccio terapeutico tra polineuropatie diabetiche dolorose e altre polineuropatie ad eccezione delle polineuropatie HIV-correlate. Essi raccomandano come prima linea: antidepressivi triciclici, alfa2deltaligandi (gabapentin, pregabalin), SNRI (duloxetina e venlafaxina) – livello A di evidenza per efficacia – e come seconda linea: tramadolo da solo oppure associato a paracetamolo (livello A di evidenza per efficacia) e come terza linea gli oppiacei per il dolore forte.
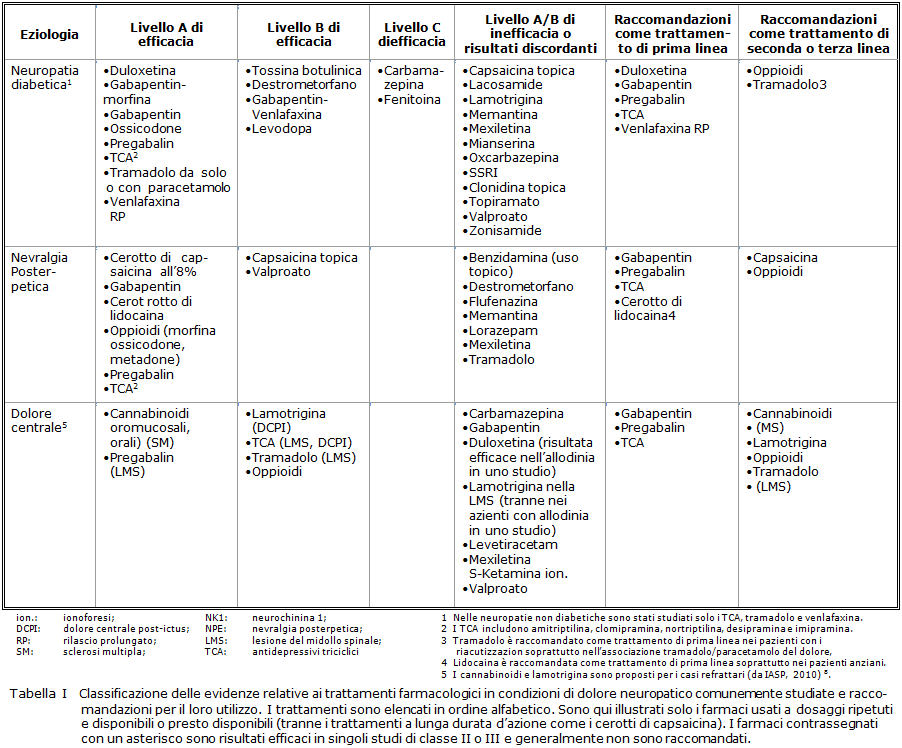
Da ultimo è bene ricordare che nel paziente diabetico possono coesistere oppure essere presenti con quadro clinico a sé stante le molteplici polineuropatie che trovano cause diverse da quelle del diabete. La diagnosi algologica, senza nulla togliere al dovere del medico di indagare la causa di polineuropatia, permette di iniziare il trattamento sintomatico senza attendere la diagnosi. A complemento si riporta la Tabella delle linee guida IASP 2010 8 (Tab. I).
Il piede diabetico
Il 15% dei pazienti diabetici è a rischio di sviluppare ulcere torpide ai piedi, mentre la prevalenza di ulcere nella popolazione diabetica varia dal 4 al 10%. La frequenza attesa è molto bassa, circa un caso per medico di medicina generale ogni 10-13 anni 9, tuttavia il peggioramento della qualità di vita per il paziente, la difficoltà di trattamento e non da ultimo i costi, motivano la forte raccomandazione a prevenire il danno con la visita periodica del piede nel paziente diabetico.
L’ulcera insorge sia per lesioni delle fibre sensitive, di norma non dolorosa se non vi è complicazione da infezione, sia per lesioni vascolari ischemizzanti, di norma molto dolorose.
Si vuole porre l’accento in questo paragrafo sull’utilità di procedere a una terapia profilattica del dolore per le medicazioni che risultano dolorose. Infatti sono molto avanzate le conoscenze su come procedere per una corretta medicazione, mentre spesso ci si dimentica di controllare il dolore.
La medicazione, soprattutto quella chirurgica, è molto dolorosa. Un’eventuale anestesia deve essere di tipo loco-regionale e non di tipo locale con tecnica d’infiltrazione. La cute perilesionale infatti, dopo infiltrazione con anestetico locale potrebbe andare incontro a necrosi. Nell’impossibilità di eseguire una anestesia loco-regionale, è utile applicare sulla lesione un’anestetico topico per circa un’ora prima della medicazione (ad es. lidocaina in crema) e/o aggiungere una terapia profilattica con oppiaceo SAO (shorting acting oppioid) come ad esempio morfina solfato in gocce (4 gocce = 5 mg 40 minuti prima della medicazione) oppure le associazioni di paracetamolo- tramadolo o paracetamolo-ossicodone (linee guida AIUC-AISLEC) 10,
Le vasculiti
Le vasculiti sono caratterizzate da un processo infiammatorio che interessa la parete dei vasi sanguigni che conduce ad alterazioni del flusso ematico e danno dell’integrità del vaso. I vasi coinvolti possono essere di diverso tipo o calibro, con conseguenze su uno o più organi o apparati. Le sindromi cliniche che ne derivano sono per lo più conseguenza dell’ischemia tissutale, del danno vasale e dell’infiammazione sistemica con febbre, anoressia e calo ponderale. Come per le polineuropatie, nel paziente diabetico possono coesistere vasculiti di altra natura (oncologiche, autoimmuni, infettive, ecc.), ma sono state riscontrate anche vasculiti alla biopsia del nervo in pazienti diabetici con neuropatia prossimale o altre forme di neuropatia focale e si è ipotizzato che le lesioni vasali dovute al diabete possano talora stimolare una reazione vasculitica secondaria con ulteriori danni ischemici del nervo 11.
Le vasculiti del sistema nervoso periferico (SNP) sono caratterizzate da infiammazione dei vasa nervorum (specialmente arteriole dell’epinervio, di diametro 30-300 μ), che determina lesioni ischemiche del nervo, configuranti la neuropatia vasculitica 12. I sintomi delle vasculiti possono essere molto simili a quelli della polineuropatia, che peraltro possono coesistere, poiché i pazienti riferiscono parestesie agli arti, bruciore, la “sindrome Restless- Legs” (cosiddetta sindrome gambe inquiete) o la “sindrome Burning-Feet” (sindrome dei piedi brucianti). È del tutto evidente che un’attenta diagnosi algologica, nel caso di vasculiti isolate, permette di rilevare il pain generator nei recettori e quindi di classificare il dolore come nocicettivo e non neuropatico, come sembrerebbe dalla descrizione dei sintomi. Nel quadro classico di vasculite all’esame obiettivo i tre test per la valutazione dell’integrità del sistema somato-sensoriale sono negativi, mentre è presente allodinia primaria (legata alla presenza di recettori “infiammati”). L’allodinia primaria si ricerca con la digitopressione sull’area di maggior dolore, ove presumibilmente sono presenti i recettori infiammati. L’allodinia secondaria (segno di coinvolgimento dei neuroni spinali diventati ipersensibili) la si ricerca con digitopressione lieve e/o pennello morbido nelle aree del dolore riferito dal paziente. La terapia appropriata prevede in primis l’utilizzo di farmaci antinfiammatori, con preferenza per lo steroide che può risultare molto efficace in tali casi, soprattutto sulla componente dolorosa. Tuttavia la strategia terapeutica va valutata con cautela, alla luce anche della frequente evoluzione spontaneamente favorevole, o autolimitantesi della vasculite 13 e soprattutto alla luce del possibile peggioramento del compenso glicemico.
Il dolore ischemico agli arti inferiori
Il dolore nell’arto ischemico può avere un’origine mista: recettoriale (quindi nocicettivo) e di fibra (quindi neuropatico). Nel paziente diabetico è spesso coinvolto il microcircolo e non è quindi efficace la terapia chirurgica di rivascolarizzazione. Inoltre la contemporanea presenza di neuropatia sensitiva rende relativamente poco dolorose le lesioni ischemiche che iniziano dalle parti distali. Tuttavia il quadro clinico che si aggrava con la compromissione prossimale della vascolarizzazione rende necessario un intervento mirato per il controllo del dolore.
Come già ribadito nell’articolo “Dolore nel paziente vasculopatico” i farmaci ritenuti efficaci e più sicuri sono gli oppiacei LAO (long acting opioid del 2° e 3° gradino WHO), opportunamente titolati, al fine di raggiungere la miglior risposta antalgica contenendo al minimo gli effetti indesiderati.
L’elettrostimolazione (spinal cord stimulation, SCS), introdotta nella pratica clinica da oltre trent’anni, è ad oggi la miglior risposta al dolore grave di natura ischemica del paziente diabetic
.
La SCS nasce come applicazione clinica della teoria del “gate control” (Melzack e Wall, 1965), ma ad oggi i meccanismi fisiopatologici e biochimici responsabili del “pain-relief” sono ancora poco chiari 14. Per contro molti studi ne evidenziano gli effetti vasodilatatori attraverso meccanismi di inibizione dell’attività simpatica efferente e attivazione della attività antidromica delle afferenze sensitive al midollo spinale oltre agli effetti sull’attività del sistema nervoso cardiaco intrinseco 15 16. La SCS trova ad oggi le seguenti indicazioni: a. ischemia critica cronica (III stadio di Fontaine); b. arteriopatie periferiche IV stadio di Fontaine; c. arteriopatie periferiche II stadio di Fontaine non rivascolarizzabili (claudicatio serrata) d. angina pectoris refrattaria e sindrome X (angina detta anche “micro vascolare” caratterizzata da episodi di ischemia miocardica in assenza di lesioni aterosclerotiche).
Le sindromi algiche nel paziente diabetico
Il trattamento del dolore acuto
Già si è detto della distinzione un po’ artificiosa tra dolore acuto e dolore cronico nel precedente articolo. Più specificatamente è utile distinguere il dolore che accompagna una malattia da causa nota e verosimilmente guaribile dal dolore che accompagna una malattia di difficile o impossibile inquadramento diagnostico o da malattia inguaribile (a causa oncologica o non).
La terapia farmacologica per il controllo del dolore la cui causa è nota permette una terapia etiologica che molto spesso risolve anche il dolore. Solo nei pazienti molto compromessi, con alterata funzione renale, è sempre opportuno evitare i farmaci antinfiammatori non steroidei (FANS): è sufficiente una somministrazione di FANS in alcuni pazienti per provocare un peggioramento acuto della funzione renale. In questi casi i farmaci più sicuri sono il paracetamolo e gli oppiacei. L’esempio può essere il trattamento del dolore da colica renale: molto più sicura un’iniezione di morfina cloridrato, che un’iniezione di ketorolac (come spesso purtroppo accade!).
Nel paziente diabetico con funzione renale non compromessa (valore del filtrato glomerulare > 60 ml/24 h) i FANS per alcuni giorni possono essere utilizzati, se ovviamente indicati (comprovata origine del dolore dai nocicettori infiammati). Infatti è comunque inappropriato uti-lizzare i FANS per la loro azione antalgica “centrale”. Così nei traumatismi, nelle flogosi articolari o periarticolari acute, nelle tendiniti, ecc.
Le cefalee costituiscono un capitolo a parte nella terapia del dolore. Si tratta di un dolore cronico perché perdura nel tempo, ma episodico e accessionale. La terapia è specifica per i vari tipi di cefalea, non vi sono particolari precauzioni se non quelle già esplicitate relativamente all’utilizzo dei FANS.
Il trattamento del dolore persistente
Nei casi in cui il dolore si protrae, perché per esempio la guarigione della malattia non è breve, è utile riflettere, nel paziente diabetico, sull’utilizzo in via continuativa dei FANS.
Nonostante l’evidenza clinica che indichi il pain generator (sito ove origina il dolore) nei nocicettori periferici infiammati, è consigliabile ridurre a un periodo minimo la somministrazione di FANS ed agire comunque sinergicamente con i farmaci modulatori della sinapsi (paracetamolo e oppiacei). L’utilizzo dei farmaci modulatori infatti è sempre possibile e, per lunghi periodi, si ritiene essere più sicuro rispetto al rischio che presentano i FANS.
Nel caso di malattie croniche a etiologia nota (polimialgia, artrite reumatoide, spondilite, ecc.) l’utilizzo del cortisone può essere irrinunciabile e si rende necessario l’aggiustamento posologico dei farmaci antidiabetici. Una nota importante invece riguarda il controllo del dolore da osteoartrosi nel paziente diabetico.
Si è già detto che l’equazione patologia = terapia antalgica specifica è concettualmente non appropriata se non in alcune singole patologie molto ben definite (esempio herpes zoster).
Il dolore da “artrosi” (patologia ad alta prevalenza peraltro direttamente proporzionale all’età) è un classico esempio di situazione in cui si rileva il maggior grado di terapia inappropriata
È necessario ribadire che applicando il metodo della diagnosi algologica è possibile definire non solo il sito di origine del dolore (che nel paziente artrosico sono sempre i nocicettori), ma la presenza o meno di ipersensibilità dei recettori stessi. Ovvero se i nocicettori sono “ipersensibili” perché “infiammati” oppure hanno sensibilità normale, ma sono sollecitati da stimoli ad alta intensità, come si osserva per esempio nel caso di processi evoluti a carico delle ginocchia o delle articolazioni coxo-femorali. È del tutto evidente che se non si dimostra chiaramente la presenza di infiammazione non sono appropriati i FANS! In questi casi possono risultare molto utili e più sicuri i farmaci oppiacei SAO: paracetamolo e sue associazioni (con tramadolo, codeina, ossicodone), tramadolo in formulazione pronta (gocce/cpr), morfina solfato in soluzione pronta. In questo caso, essendo il dolore prevedibile, è sufficiente assumere l’oppiaceo in via profilattica 30-40 minuti prima della deambulazione che si preveda essere dolorosa.
Nel caso si dimostri con l’esame obiettivo la presenza di flogosi vi è indicazione a terapia con FANS o steroidi (evitare nel modo assoluto l’associazione!). È chiaro che nel paziente diabetico l’utilizzo dei FANS va circoscritto al tempo strettamente necessario a ridurre la flogosi.
La terapia multimodale del dolore (utilizzo di più farmaci con azione sinergica) permette di ridurre le dosi dei singoli farmaci e sospendere farmaci ritenuti meno sicuri nella somministrazione per lunghi periodi (esempio FANS).
Nessuna controindicazione all’utilizzo di farmaci oppiacei nel lungo periodo per i pazienti diabetici, con l’avvertenza che vi sono ancora pochi dati sugli effetti collaterali di una terapia con oppiacei protratta “sine die”, soprattutto nei soggetti giovani.
Il trattamento del dolore oncologico
Non vi sono differenze tra dolore oncologico e non oncologico dal punto di vista neurofisiologico, mentre è sostanziale il differente approccio, soprattutto nel malato di cancro con malattia evolutiva e inguaribile.
Si desidera focalizzare l’attenzione soprattutto sul dolore nel malato in fase terminale di malattia. In questi casi il dolore diventa “totale” e coinvolge tutte le dimensioni della persona umana (fisico-psiche-spiritualità). Il compenso della malattia diabetica, attraverso il controllo glicemico, perde di significato mano a mano che ci si avvicina al “confine alto” della vita, mentre diventa sempre più imperativo il controllo dei sintomi e del dolore. In questa fase la terapia multimodale del dolore si applica nella sua interezza e prevede l’associazione se opportuna ed efficace di tutti gli antalgici ad iniziare dai FANS. È sempre più evidente che il pain generator nel dolore da cancro è costituito dal recettore periferico e/o viscerale ipersensibile per processo flogistico generato dal cancro stesso. È sempre presente ipersensibilità spinale, trattandosi di stimoli continui al midollo. È molto spesso presente il coinvolgimento dei plessi nervosi con invasione e lesione delle fibre nervose. Per questo i criteri guida nel dolore in fase di terminalità sono l’intensità del dolore (che deve essere ricondotta a valori di NRS < 4) e gli effetti collaterali della terapia antalgica ridotti al minimo con piani personalizzati di cura.
Bibliografia
-
Ministero della Salute. Il dolore cronico in Medicina Generale. Roma: Agenzia Nazionale per i servizi regionali aprile 2010.
-
Wong M-C, Chung JWY, Wong TKS. Effects of treatments for symptoms of painful diabetic neuropathy: systematic review. BMJ 2007;335:87.
-
Fedele D, Comi G, Coscelli C, et al. A multicenter study on the prevalence of diabetic neuropathy in Italy. Diabetes Care 1997;20:836-43.
-
Partanen J, Niskanen L, Lehtinen J, et al. Natural history of peripheral neuropathy in patients with non-insulin-dependent diabetes mellitus. N Engl J Med 1995;333:89-94.
-
Daousi C, MacFarlane IA, Woodward A, et al. Chronic painful peripheral neuropathy in an urban community: a controlled comparison of people with and without diabetes. Diabetic Medicine 2004;21:976-82.
-
Maija LH, Misha-Miroslav B, Bennett M, et al. Assessment of neuropathic pain in primary care. Am J Med 2009;122(Suppl 10):S13-21.
-
Attala N, Cruccua G, Barona R, et al. EFNS guidelines on the pharmacological treatment of neuropathic pain: 2010 revision. Eur J Neurol 20101;17:1113-23.
-
IASP. Pharmacological management for neuropathic pain. Pain Clin Updates 2010;XVIII:3.
-
Medea G. Visitare il piede del diabetico. Rivista SIMG 2003;(1):58-61.
-
AIUC-AISLEC. Linee guida per la gestione del dolore nel paziente con lesioni cutanee croniche 2010.
-
Said G, Goulon-Goeau C, Lacroix C, et al. Proximal diabetic neuropathy - Clinical aspects and morphological findings in the biopsy specimens of the intermediate cutaneous nerve of the thigh. Ann Neurol 1994;35:559-69.
-
Kissel JT, Rammohan KW, Mendell JR. Pathogenesis and therapy of nervous system vasculitis. Clin Neuropharmacol 1991;14:28-48
-
Said G, Elgrably F, Lacroix C, et al. Painful proximal diabetic neuropathy: inflammatory nerve lesions and spontaneous favourable outcome. Ann Neurol 1997;41:762-70.
-
Mercadante S. Il dolore. Milano: Elsevier-Masson Editore 2008.
-
Augustinsson LE. Carlsson CA, Holm J, et al. Epidural elettric stimulation in severe limb ischemia. Ann Surg 1985;202:104-10
-
Foreman RD, Linderoth B, Ardell JR, et al. Modulations of intrinsic cardiac neurons by spinal corde stimulation: implications for its therapeutic use in angina pectoris. Cardiovasc Res 2000;47:367-75.



